
Archive / Конспект лекций от 02.04.12 - копия / ПАРООБРАЗОВАНИЕ 9
.docx
ПАРООБРАЗОВАНИЕ.
НАСЫЩЕННЫЙ И НЕНАСЫЩЕННЫЙ ПАР.
1.Парообразование.
Между молекулами вещества, находящегося в жидком или твёрдом состоянии, действуют силы притяжения. Для твёрдого вещества они достаточно велики. Это приводит к тому, что молекулы твёрдого вещества малоподвижны, они могут только колебаться около своего положения равновесия. В жидкости молекулы не так сильно притягиваются друг к другу, они могут перемещаться на небольшие расстояния и перескакивать на соседние положения равновесия. Однако, в результате обмена энергиями при соударениях молекул или в результате поступления энергии извне, какая-то отдельная молекула может получить такое количество кинетической энергии, которое позволит ей преодолеть силы притяжения со стороны соседних молекул и покинуть поверхность жидкости или твёрдого вещества. Некоторые из этих молекул, потеряв свою энергию, возвращаются обратно в жидкость или твёрдое вещество, но самые энергичные, которые смогли удалиться на расстояние около 10-9 м, где силы притяжения уже практически не действуют, становятся свободными.
Переход вещества из твёрдого или жидкого состояния в газообразное называется парообразованием, а совокупность молекул вещества, покинувших поверхность жидкости или твёрдого тела, называется паром этого вещества.
Чаще всего под парообразованием понимается переход вещества в газообразное состояние из жидкого. Парообразование, происходящее из твёрдого состояния, называется возгонкой или сублимацией.
Парообразование из жидкого состояния разделяют на испарение и кипение.
2.Испарение и его интенсивность.
Испарение – это парообразование, происходящее при любой температуре только со свободной поверхности жидкости в воздух или вакуум, сопровождающееся понижением температуры жидкости.
Механизм испарения и происходящее при этом охлаждение жидкости можно объяснить с точки зрения МКТ.
Как уже говорилось выше, поверхность жидкости покидают только те молекулы, кинетическая энергия которых превышает значение работы, необходимой для преодоления сил молекулярного притяжения со стороны соседних молекул и выхода молекулы с поверхности жидкости в воздух. Эта работа называется работой выхода. В результате средняя кинетическая энергия оставшихся молекул уменьшается и, следовательно, температура жидкости понижается.
Интенсивность испарения зависит от нескольких факторов:
-
от температуры жидкости;
-
от площади свободной поверхности;
-
от скорости удаления паров с поверхности жидкости;
-
от внешнего давления;
-
от рода жидкости.
Чем выше температура, чем больше площадь свободной поверхности, чем больше скорость удаления паров с поверхности жидкости, чем меньше внешнее давление, тем испарение идёт интенсивней.
Процесс перехода вещества из газообразного состояния в жидкое или твёрдое называется конденсацией.
3.Насыщенные и ненасыщенные пары.
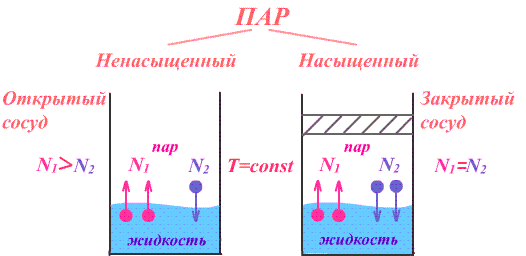
Рассмотрим два сосуда с жидкостью – один открытый, другой закрыт крышкой. В обоих сосудах происходит и испарение жидкости, и конденсация пара.
Однако в первом случае, испарение преобладает над конденсацией, так как молекулы жидкости имеют возможность покинуть пределы сосуда и в жидкость они не возвратятся, а на их место с поверхности жидкости в воздух выходят другие молекулы. Число молекул N1, покидающих поверхность за 1 с, превышает число молекул N2, возвращающихся обратно. Если процесс испарения преобладает над процессом конденсации, то образующийся пар называется ненасыщенным.
В герметически закрытом сосуде вначале число молекул N1, покидающих поверхность за 1 с, превышает число молекул N2, возвращающихся обратно. Поэтому плотность пара над поверхностью жидкости, а также его давление возрастают. Но по мере увеличения плотности и давления возрастает количество молекул, возвращающихся в жидкость в течение 1 с. Через некоторое время скорости испарения и конденсации становятся одинаковыми, т.е. количество вылетевших из жидкости молекул N1 равно количеству возвратившихся N2. Говорят, что между паром и его жидкостью установилось динамическое равновесие.
Пар, находящийся в состоянии динамического равновесия со своей жидкостью, называется насыщенным.
4.Кипение.
Кипение – это парообразование, происходящее и с поверхности, и во всём объёме жидкости при постоянной температуре.
Механизм кипения можно объяснить следующим образом.
На стенках сосуда всегда имеются пузырьки адсорбированного газа. Кроме того, в жидкости всегда присутствует некоторое количество растворённого газа (воздуха), степень растворения которого понижается с ростом температуры, и который при нагревании начинает выделяться также в виде пузырьков. Вовнутрь пузырьков происходит испарение жидкости. Поэтому кроме воздуха внутри пузырьков находится насыщенный пар, его давление с ростом температуры увеличивается. Следовательно, пузырьки раздуваются. Действующая на пузырьки сила Архимеда становится больше их силы тяжести, и они начинают всплывать. Дальнейшее поведение пузырьков зависит от того, насколько прогрета жидкость.
Если жидкость ещё не равномерно прогрета и верхние её слои холоднее нижних, то по мере всплывания пузырьков пар внутри них конденсируется, давление внутри пузырьков уменьшается. Следовательно, уменьшается и объём пузырьков. Зависящая от объёма пузырьков сила Архимеда также становится меньше, движение пузырьков наверх замедляется и, не дойдя до поверхности жидкости, пузырьки исчезают.
Если жидкость прогрета равномерно, то по мере всплывания пузырьков объём их будет возрастать, так как уменьшается сила гидростатического давления жидкости, действующая на пузырьки. Увеличение объёма приводит к увеличению силы Архимеда. Поэтому движение пузырьков наверх ускоряется. Пузырьки достигают свободной поверхности, лопаются, и насыщенный пар выходит наружу. Этот момент называется кипением жидкости. При этом давление насыщенного пара в пузырьках практически равно внешнему давлению.
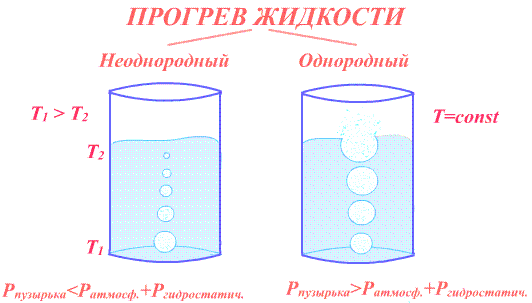
Температура, при которой давление насыщенного пара равно внешнему давлению, называется температурой кипения.
Температура кипения зависит:
1) от внешнего давления (чем оно больше, тем температура кипения выше);
2) от наличия примеси (обычно температура кипения увеличивается с ростом концентрации примеси);
3) от растворённого в жидкости воздуха или других газов (с уменьшением количества растворённого воздуха температура повышается);
4) от состояния стенок сосуда (в сосудах с более гладкими стенками жидкость закипает при более высокой температуре);
5) от рода жидкости.
5.Сравнение свойств насыщенного пара и идеального газа.
1.Давление и плотность насыщенного пара постоянны и не зависят от объёма пространства над испаряющейся жидкостью. Для идеального газа давление и плотность уменьшаются с ростом объёма.
Насыщенный
пар Идеальный газ
2.С увеличением температуры при неизменном объёме рост давления насыщенного пара происходит не по линейного закону, как для идеального газа, а гораздо быстрее. Это объясняется тем, что увеличение давления происходит не только за счёт увеличения кинетической энергии, но и за счёт увеличения количества испарившихся молекул.
По этой же причине
плотность насыщенного пара не остаётся
постоянной, она возрастает.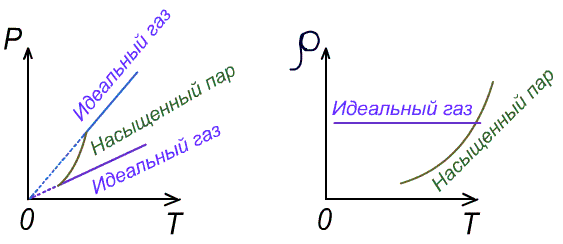
3.Давление и плотность насыщенного пара зависят от рода жидкости и определяются теплотой парообразования. Чем меньше теплота парообразования, тем больше давление и плотность насыщенного пара.
