
PAKhT_LABI / Лабораторна робота №18
.docМіністерство освіти і науки України
Національний університет “Львівська політехніка”

Звіт
з лабораторної роботи №18
з курсу „ПАХТ ”
Львів-2007
-
Мета роботи
Визначення коефіцієнту масопередачі К для абсорбції СО2 розчином лугу з повітряної суміші.
-
ОСНОВНІ ТЕОРЕТИЧНІ ПОЛОЖЕННЯ
Абсорбцією називається процес поглинання газів або парів з газової та паро-газової суміші рідкими поглиначами ( абсорбентами ). При фізичній абсорбції газ, який поглинається, не взаємодіє хімічно з абсорбентом. Якщо компонент, що поглинається утворює з абсорбентом хімічні сполуки, то процес називається хемосорбцією. Фізична абсорбція в більшості випадків є зворотною. Зворотний процес – виділення поглинутого газу з поглинача – називається десорбцією.
В промисловості процеси абсорбції застосовуються для вилучення цінних компонентів з газових сумішей та для очищення цих сумішей від шкідливих домішок.
При абсорбції вміст газу в розчині залежить від властивостей газу або рідини: тиску, температури і складу газової суміші (парціального тиску абсорбтиву).
В багатьох випадках поглинання газу рідиною супроводжується хімічною взаємодією фаз. При протіканні реакції в рідкій фазі частина газоподібного компоненту переходить в зв'язаний стан. При цьому концентрація вільного компоненту в рідині зменшується, що призводить до прискорення процесу абсорбції оскільки збільшується рушійна сила процесу .Швидкість хемосорбції залежить як від швидкості реакції, так і від швидкості масопередачі між фазами. В залежності від того, який процес визначає загальну швидкість процесу переносу маси, розрізняють кінетичну і дифузійну області протікання хемосорбційних процесів.
В кінетичній області швидкість власне хімічної взаємодії менша швидкості масопередачі і тому лімітує швидкість цього процесу.
В дифузійній області лімітує процес хемосорбції швидкість дифузії компонентів в зоні реакції, яка залежить від гідродинаміки та фізичних властивостей фаз. При спів-розмірності швидкості реакції і масопередачі процес абсорбції протікає в змішаній (дифузійно-кінетичній) області.
В результаті масообміну між газоподібною і рідкою фазами концентрація компоненту, що поглинається, в газовій фазі змінюється від yп до yк, а в рідкій фазі від xп до xк. Кількість компоненту, що перейшов з газової фази, складає:
![]() , (1)
, (1)
Рушійною силою процесу абсорбції (рис.1) в будь-якому перерізі абсорбційної колони є різниця між робочою та рівноважною концентраціями (yроб yрівн). Рушійна сила змінюється по висоті абсорбера, тому вводиться поняття середньої рушійної сили по газовій фазі:
 , (2)
, (2)
де yб = yп yрп;
yм = yк yрк.
Оскільки СО2 добре реагує з розчином NaOH , то концентрація CO2 під поверхнею рідини близька до нуля і можна прийняти:
yрп = 0, yрк = 0.
 , (3)
, (3)![]()
Швидкість процесів абсорбції характеризується рівнянням (4), якщо рушійну силу yсер виразити в концентраціях газової фази:
![]() , (4)
, (4)
і рівнянням (5), якщо рушійна сила xсер виражена в концентраціях рідкої фази:
![]() , (5)
, (5)

Рис.1.
В цих рівняннях коефіцієнти масопередачі Ky і Kx визначаються таким чином:
 , (6)
, (6)
і
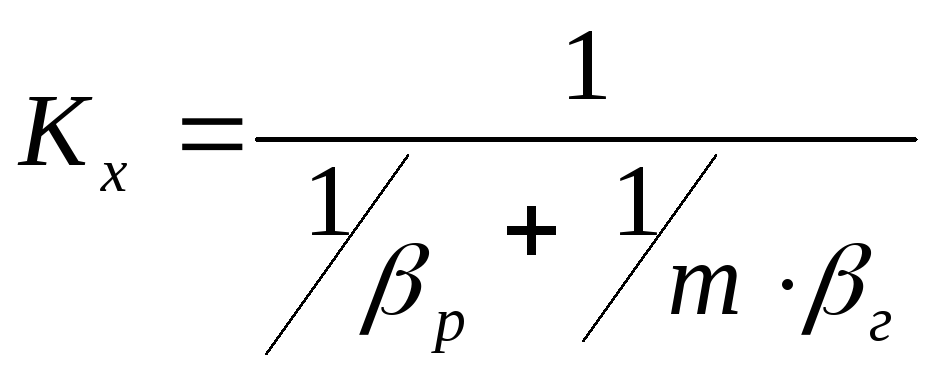 , (7)
, (7)
де г – коефіцієнт масовіддачі від потоку газу до поверхні контакту фаз;
р коефіцієнт масовіддачі від поверхні контакту фаз до потоку рідини ;
m тангенс кута нахилу рівноважної лінії.
-
Опис лабораторної установки
Абсорбер 1 діаметром Dx = 160x10 мм і висотою 3000 мм наповнений насадкою 2 (кільця Рашига 50x50x7 мм). Висота насадкового шару 1380 мм. Розчин NaOH (7 %) за допомогою помпи 8 попадає зі збірника в верхню частину абсорбера. Кількість рідини фіксується ротаметром 3. Стікаючи по насадці, рідина зливається назад в збірник. Газ, що абсорбується (CO2) з балону 7 дроселюється редукційним вентилем 5. Витрата газу визначається по ротаметру 4. Газ змішується з повітрям, що подається в систему вентилятором 9. Кількість газової суміші, що подається в абсорбер, визначається трубкою Піто-Прандтля 11, яка приєднана до мікроманометра 10. Витрата рідкої та газової фаз регулюється запірно-регулюючою арматурою 6. Вентилі 12 використовуються для відбирання проб газу з нижньої та верхньої частини абсорбера.

-
Порядок виконання роботи
Включають помпу 8 і за допомогою вентилів 6 встановлюють по ротаметру 3 задану витрату рідини. Після цього включають вентилятор 9 та вентилем 6 встановлюють необхідну витрату повітря. Редукційним вентилем 5 в лінію подачі повітря дроселюють з балону 7 вуглекислий газ. Через 3-5 хвилин відбирають проби газової суміші в верхній та нижній частинах абсорбера. Відбирання проб проводиться відкриванням вентилів 12. Концентрація СО2 в газовій суміші визначається за допомогою газоаналізатора.
-
Обробка експериментальних даних
Обробка дослідних даних зводиться до визначення коефіцієнту масопередачі К з рівняння (4):
![]() , (8)
, (8)
Для цього необхідно визначити:
-
максимальну швидкість руху газової суміші, м/с:
 ,
м/с, (9)
,
м/с, (9)
де g = 9,81 м/с2 – прискорення вільного падіння;
Н – покази мікроманометра;
k – поправочний коефіцієнт мікроманометра;
м – питома густина рідини в мікроманометрі, кг/м3;
сум – густина газової суміші при температурі досліду, кг/м3.
-
густину газової суміші:
![]() , кг/м3, (10)
, кг/м3, (10)
де Р0 = 750 мм рт. ст.;
Т0 = 273°К;
Мсум = МCO2 y + Мпов (1 y) – мольна маса суміші;
-
критерій Рейнольдса:
![]() , (11)
, (11)
де d – діаметр газопроводу в місці під'єднання трубки Піто-Прандтля, м;
в'язкість газової суміші, визначається з рівняння:
 ;
;
В залежності від величини Re знаходиться співвідношення W/Wmax.
-
середню швидкість руху газової суміші:
![]() ,
м/с, (12)
,
м/с, (12)
-
площу поперечного перерізу газопроводу в місці встановлення трубки Піто-Прандтля:
![]() ,
м2, (13)
,
м2, (13)
де d – діаметр газопроводу в місці встановлення трубки Піто-Прандтля (dx' = 52x2 мм).
-
густину повітря в умовах досліду:
![]() ,
кг/м3, (14)
,
кг/м3, (14)
-
об'ємну витрату СО2:
![]() ,
м3/с, (15)
,
м3/с, (15)
-
об'ємну витрату повітря:
![]() ,
м3/с, (16)
,
м3/с, (16)
-
об'ємну витрату газової суміші:
![]() ,
м3/с, (17)
,
м3/с, (17)
-
масову витрату повітря:
![]() ,
кг/с, (18)
,
кг/с, (18)
-
кількість поглинутого СО2:
![]() ,
кг, (19)
,
кг, (19)
де yп yк – концентрації СО2 в газовій суміші відповідно на вході (внизу) та на виході (вверху) колони , кг/кг інертного газу.
Перерахунок об'ємної долі СО2 у відносну масову концентрацію:
![]() ,
кг СО2/кг
повітря, (20)
,
кг СО2/кг
повітря, (20)
-
середню рушійну силу процесу хемосорбції (знаходиться за формулою (3).
-
площу поверхні насадки:
![]() ,
м2, (21)
,
м2, (21)
де D – діаметр абсорбера, 0,14 м;
Н – висота шару насадки, 1,38 м;
питома поверхня насадки, 63 м2/м3.
Таблиця 1
|
Ky, кг/м2с |
yсер |
М, кг |
G, кг/с |
w/wmax |
сум, Пас |
сум, кг/м3 |
wmax |
Vсум |
|
1,91102 |
6,55102 |
1,67103 |
2,79102 |
0,9 |
1,73105 |
1,2 |
0,71 |
2,4102 |
-
Розрахунки

