
LABORATORNIJ_PRAKTIKUM_Z_FIZIKI
.pdf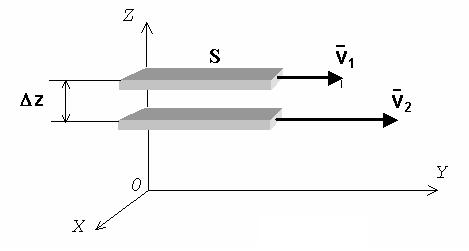
Розділ 6. ЯВИЩА ПЕРЕНЕСЕННЯ
В термодинамічно нерівноважних системах (системах, у яких змінюються термодинамічні параметри) виникають особливі необоротні процеси, які називають процесами перенесення. У результаті таких процесів відбувається просторове перенесення енерґії, маси, імпульсу. До явищ перенесення належать: внутрішнє тертя (перенесення імпульсу), теплопровідність (перенесення енерґії) і дифузія (перенесення маси).
Розглянемо коротко суть цих явищ, обмежившись одномірним випадком, коли вісь OZ збігається з напрямком перенесення.
6.1. Внутрішнє тертя (в’язкість)
В’язкість – це властивість реальних рідин та газів чинити опір при переміщенні однієї частини рідини відносно іншої. У рухомій рідині між окремими шарами, які мають різні швидкості відносного руху, виникають сили внутрішнього тертя, напрямлені по дотичній до поверхні шарів. Внаслідок теплового руху молекули переходять з одного шару в інший, переносячи при цьому свій імпульс mv впорядкованого руху. Обмін молекулами між шарами, які рухаються з різними швидкостями, є причиною того, що імпульс швидшого шару зменшується, а повільнішого – зростає. Тобто швидший шар гальмується, а повільніший – прискорюється. У цьому полягає ме – ханізм виникнення сил внутрішнього тертя.
Ньютон експериментально встановив, що величина сили внутрішнього тертя FT прямо пропорційна площі поверхні шару рідин S і ґрадієнту швидкості .
Ґрадієнт швидкості визначає величину зміни швидкості на одиницю віддалі при переході від одного шару рідини до іншого в напрямі ОZ, перпендикулярному напряму руху шарів.
Рис. 6.1
41

Теоретична частина
На рис. 6.1 показані два шари рідини, віддалені на z, які рухаються з швидкостями v1 і v2 перпендикулярно до ОZ.
Сила внутрішнього тертя між шарами напрямлена протилежно
до напряму швидкості швидшого шару і становить: |
|
||||
|
dv |
|
|
|
|
F = η |
|
S, |
(6.1) |
||
dz |
|||||
|
|
|
|||
де η − коефіцієнт пропорційності, який називається коефіцієнтом в’язкості, або динамічною в’язкістю;
dvdz − ґрадієнт швидкості,
S− площа поверхні шарів.
Зформули (6.3) випливає, що:
η = |
|
F |
|
. |
(6.2) |
|
|
|
|
||||
|
|
dv |
|
S |
|
|
|
|
dz |
|
|||
|
|
|
|
|
||
Коефіцієнт в’язкості чисельно дорівнює силі тертя, яка виникає між шарами рідини одиничної площі при ґрадієнті швидкості, що дорівнює одиниці.
Коефіцієнт в’язкості вимірюється в – Па∙с (паскаль-секунда). Розглянемо найпоширеніші методи визначення коефіцієнта
в’язкості рідини.
Метод Стокса
Метод ґрунтується на вимірюванні швидкості невеликих сферичних тіл, що повільно рухаються в рідині. При русі в рідині тверде тіло покривається тонким нерухомим відносно тіла шаром рідини, і сили внутрішнього тертя виникають між шарами рідини, а не між твердим тілом і рідиною. Отже, сила внутрішнього тертя не залежить від матеріалу твердого тіла, яке рухається в рідині, а залежить тільки від форми тіла і властивостей рідини.
При падінні тіла у в’язкій нерухомій рідині на тіло діють:
∙сила тяжіння mg, напрямлена вертикально донизу;
42

Розділ 6. Явища перенесення
∙виштовхувальна сила (сила Архімеда) FA, напрямлена вертикально догори;
∙сила тертя FT, також напрямлена вертикально догори
(рис. 6.2).
Рис. 6.2
Якщо тіло має форму кулі радіуса r, густина тіла ρ т, густина рідини ρ р, то:
mg = |
|
4 |
πr3ρTg; |
(6.3) |
|||||
3 |
|||||||||
|
|
|
|
|
|
||||
F |
= |
4 |
πr3ρ |
P |
g. |
(6.4) |
|||
|
|||||||||
A |
|
3 |
|
|
|
|
|||
|
|
|
|
|
|
|
|||
Сила тертя пропорційна швидкості руху кульки v і |
|||||||||
визначається законом Стокса: |
|
|
|
|
|
|
|
|
|
FT |
= 6πρrv . |
|
(6.5) |
||||||
На початковій ділянці рух кульки – прискорений, але із збільшенням швидкості зростає FT, і рівнодійна сил, що діють на кульку, стає рівною нулю. Тому:
mg = FA + FT.
Підставивши (6.3), (6.4) і (6.5) в (6.6), одержимо:
34 πr3ρTg = 34 πr3ρPg + 6πρrv.
З отриманого виразу визначимо коефіцієнт в’язкості:
η = 2r2(ρT − ρP )g.
9v
43
(6.6)
(6.7)
(6.8)

Теоретична частина
Метод Пуазейля
Для визначення коефіцієнта в’язкості рідини використовують формулу Пуазейля для ламінарної течії по трубках (капілярах):
V = |
πΔpr 4 t |
, |
(6.9) |
|
8ηL |
||||
|
|
|
де L − довжина капіляра; r − радіус капіляра;
p − різниця тисків на кінцях капіляра;
V − об’єм рідини, яка витекла через капіляр за час t; η− коефіцієнт в’язкості рідини.
При відомих V, r, L, p , використовуючи (6.9), можна визначити η.
Однак значно зручніше користуватись формулою Пуазейля для відносного визначення коефіцієнта в’язкості. Візьмемо дві рідини, коефіцієнт в’язкості однієї з яких відомий (позначимо його η0 ),
а іншої – невідомий η1, і виміряємо час |
витікання однакового |
|||
об’єму рідин через один і той же капіляр – t0 |
і t1 відповідно. |
|||
Записавши формулу Пуазейля для кожної з рідин і поділивши |
||||
один вираз на другий, отримаємо: |
|
|
|
|
η1 = η0 |
t1 |
p1 |
. |
(6.10) |
t0 |
|
|||
|
p0 |
|
||
Оскільки рідина витікає під дією сили тяжіння, то
p1 = ρ1 , p0 ρ0
і вираз для коефіцієнта в’язкості набуде вигляду:
η1 = η0 t1ρ1 . (6.11)
t0ρ0
Отже, вимірявши час витікання рідин, а також використавши відомі значення ρ 0 та η0 однієї з них, визначимо коефіцієнт в’язкості іншої.
44

Розділ 6. Явища перенесення
6.2. Теплопровідність
Якщо в одній області газу середня кінетична енерґія молекул більша ніж в іншій, то з часом внаслідок постійних зіткнень відбудеться вирівнювання середніх значень кінетичної енерґії молекул, тобто вирівнювання температури.
Перенесення енерґії в формі теплоти описується законом Фур’є:
JE |
= −λ |
dT |
, |
(6.12) |
|
dz |
|||||
|
|
|
|
де JE − густина теплового потоку, яка визначається енерґією, що переноситься у формі теплоти за одиницю часу через поверхню одиничної площі, перпендикулярну до осі ОZ;
λ− теплопровідність, яка чисельно дорівнює густині теплового потоку при одиничному ґрадієнті температури;
dTdz − ґрадієнт температури в напрямі осі ОZ.
Знак (−) показує, що енерґія переноситься у напрямі зменшення температури.
6.3. Дифузія
Явище самовільного взаємопроникнення і перемішування частинок двох газів, рідин чи навіть твердих тіл, які дотикаються, називають дифузією. Дифузія призводить до обміну частинками маси тіл, які дотикаються, і виникає та продовжується, поки існує ґрадієнт густини. Явище дифузії описується законом Фіка:
J = −D |
dρ |
, |
(6.13) |
m dz
де Jm – густина потоку маси, яка визначається масою речовини, що дифундує за одиницю часу через поверхню одиничної площі перпендикулярно до осі ОZ;
D – коефіцієнт дифузії, який чисельно дорівнює густині потоку маси при одиничному ґрадієнті густини;
45

Теоретична частина
dρ |
– ґрадієнт густини в напрямі осі ОZ. Знак (−) показує, що |
|
dz |
||
|
перенесення маси відбувається у напрямку зменшення густини. Між коефіцієнтами явищ перенесення існують такі залежності:
η = ρ ×D;
(6.14)
λ = 1.
ηcV
де сv – питома теплоємність речовини при постійному об’ємі.
46
Розділ 7. ТЕРМОДИНАМІКА
7.1. Основні поняття термодинаміки
Термодинаміка вивчає найбільш загальні макроскопічні властивості тіл, що проявляються при перетвореннях одних видів енергії в інші. Надалі тіло чи систему тіл будемо називати
термодинамічною системою.
Стан термодинамічної системи задається за допомогою таких величин, як:
∙р – тиск;
∙V – об’єм;
∙Т – температура.
Ці величини називаються термодинамічними параметрами.
У стані термодинамічної рівноваги всі параметри системи не змінюються з часом, а тиск і температура є однаковими в усіх частинах системи. При цьому термодинамічні параметри зв’язані між собою рівнянням, яке називається рівнянням стану. Рівняння стану ідеального газу – це рівняння Менделєєва–Клапейрона.
pV = |
MRT , |
(7.1) |
|
μ |
|
де M – маса газу;
μ – молярна маса;
R = 8,31 Дж/(моль К) – універсальна газова стала.
Важливим поняттям термодинаміки є поняття внутрішньої енерґії. Внутрішня енерґія U ідеального газу складається лише з середньої кінетичної енерґії молекул газу і залежить від температури газу:
U = |
M |
i |
RT , |
(7.2) |
|
||||
|
μ 2 |
|
||
де і – число ступенів вільності молекули.
Для реальних газів внутрішня енерґія залежить і від інших термодинамічних параметрів. Внутрішня енерґія є функцією стану системи: кожному стану системи відповідає певне значення внутрішньої енерґії. При переході системи зі стану 1 в стан 2 зміна внутрішньої енергії дорівнює:
U = U2 − U1. |
(7.2а) |
47

Теоретична частина
Якщо після проходження проміжних станів система повертається у початковий стан, то:
U = 0. |
(7.2б) |
7.2. Перший закон термодинаміки
Обмін енерґією між термодинамічною системою і зовнішніми тілами може відбуватися двома способами:
∙шляхом теплообміну ( системі передається кількість теплоти Q);
∙шляхом виконання роботи.
Формулювання першого закону термодинаміки:
Кількість теплоти Q, яка надається системі, витрачається на збільшення внутрішньої енерґії системи
U і на виконання роботи А проти зовнішніх сил.
Q = U + A. |
(7.3) |
Зазвичай цей закон записують для безмежно малих величин:
δ Q = dU + δ A. |
(7.4) |
Відмінність у позначеннях величин пов’язана з тим, що dU означає зміну внутрішньої енергії, а δ А і δ Q − лише безмежно малі величини.
δ A = pdV. |
(7.5) |
Перший закон термодинаміки запишемо у вигляді:
δ Q = dU + pdV. |
|
(7.6) |
|
Застосуємо перший закон термодинаміки до ізопроцесів в |
|||
ідеальних газах: |
|
|
|
∙ ізохорний процес ( М,V = const ) |
p |
= const |
|
T |
|||
|
|
||
Якщо V =const, то dV = 0, отже δ A = 0. Тому: |
|||
δ Q = dU. |
|
(7.7) |
|
При ізохорному процесі вся теплота, надана системі, йде на збільшення внутрішньої енерґії системи.
48

Розділ 7. Термодинаміка
∙ ізотермічний процес (М, T = const ) |
pV = const |
Якщо T = const, то з (7.2) U = const і dU = 0, отже: |
|
δ Q = δ A. |
(7.8) |
При ізотермічному процесі вся теплота, надана системі, йде на виконання системою роботи проти зовнішніх сил. Якщо об’єм системи змінюється від V1 до V2 , то виконана системою робота
описується формулою: |
|
|
|
|
|
|
A = МRTln |
V2 |
. |
(7.9) |
|||
|
||||||
μ |
|
V |
|
|
|
|
|
1 |
|
|
|
|
|
Якщо система розширюється ( V2>V1), то А>0; |
||||||
при стиску системи (V2<V1) |
A<0. |
|||||
∙ ізобарний процес ( М, p = const ) |
|
V |
= const |
|||
|
|
|||||
|
|
|
|
|
T |
|
Формулювання першого закону термодинаміки для ізобарного |
||||||
процесу збігається із загальним формулюванням. Робота, |
||||||
виконана при ізобарному розширенні системи від об’єму V1 |
||||||
до об’єму V2, |
|
|
|
|
|
|
V2 |
|
|
|
|
|
|
A = òpdV = p(V2 − V1 ). |
(7.10) |
|||||
V1 |
|
|
|
|
|
|
При стиску системи (V2<V1) |
A<0. |
|
|
|
||
7.3. Теплоємність
Теплоємністю тіла називається фізична величина, яка чисельно дорівнює кількості теплоти, яку потрібно надати тілу, щоби нагріти його на один кельвін.
Молярна теплоємність – це теплоємність одного моля речовини. Позначається великою літерою С.
Питома теплоємність – це теплоємність одного кілограма речовини. Позначається малою літерою с.
Зв’язок між молярною і питомою теплоємностями:
С = μc. (7.11)
Кількість теплоти, яка йде на нагрівання тіла масою М:
Q = cМ(T − T ) = |
MC(T − T ). |
(7.12) |
|||
2 |
1 |
μ |
2 |
1 |
|
|
|
|
|
|
|
|
49 |
|
|
|
|

Теоретична частина
Кількість теплоти, що йде на нагрівання при безмежно малій
зміні температури : |
|
|
δQ = |
MCdT . |
(7.13) |
|
μ |
|
Теплоємність газу істотно залежить від умов, при яких він нагрівається.
Молярна теплоємність ідеального газу при сталому об’ємі СV:
Згідно з (7,7):
|
M |
|
|
|
|
|
|
|
|
æ M |
ö |
|
dU = |
μ |
C |
V |
dT , а для одного моля |
ç |
|
= 1÷: |
|||||
|
||||||||||||
|
|
|
|
|
|
|
|
è μ |
ø |
|||
|
|
|
|
dUμ = CVdT . |
|
|
(7.14) |
|||||
Згідно з (7,2) : |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
dUμ = |
|
i |
|
RdT . |
|
|
(7.15) |
|
|
|
|
|
2 |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
||
Прирівнявши праві частини (7,14) і (7,15) одержимо: |
||||||||||||
|
|
|
|
CV |
= |
i |
R . |
|
|
(7.16) |
||
|
|
|
|
|
|
|
||||||
|
|
|
|
|
2 |
|
|
|
|
|||
Молярна теплоємність ідеального газу при сталому тиску СP:
Перший закон термодинаміки, записаний для одного моля, має вигляд:
δQμ = dUμ + pdVμ . |
(7.17) |
Врахувавши, що на основі (7,15) і (7,16) : |
|
dUμ = CVdT |
(7.18) |
і що з рівняння (7.1), записаного також для одного моля і продиференційованого за параметром T при p = const, маємо:
pdVμ = RdT . |
(7.19) |
Рівняння (7.17) перепишемо у вигляді: |
|
δQμ = CVdT + RdT . |
(7.20) |
Але згідно з (7.13) |
|
δQμ = CPdT . |
(7.21) |
Тому на основі (7.20) і (7.21) запишемо: |
|
CP = CV + R . |
(7.22) |
50 |
|
