Лабораторна робота № 30
ВИЗНАЧЕННЯ ВІДНОШЕННЯ ТЕПЛОЄМНОСТЕЙ СP/CV ПОВІТРЯ
МЕТОДОМ КЛЕМАНА–ДЕЗОРМА
171
Інструкції до лабораторних робіт
Мета роботи
Ознайомлення з методом Клемана−Дезорма та визначення γ = СP/CV повітря.
Прилади та обладнання
Балон, рідинний манометр, мікрокомпресор.
Опис вимірювального пристрою та виведення розрахункової формули
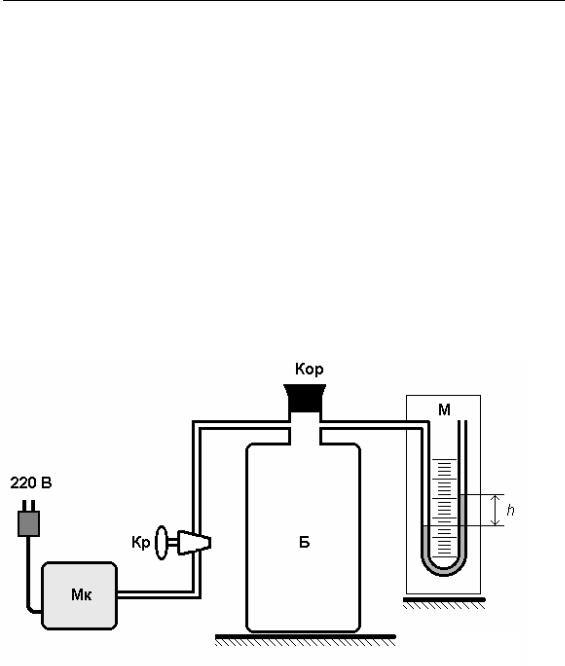
Рис. 1
Відношення γ = СP/CV можна визначити багатьма експериментальними методами, зокрема за допомогою приладу Клемана–Дезорма, що складається з:
∙скляного балона Б, закритого корком К;
∙рідинного манометра М, під’єднаного до балона Б;
∙мікрокомпресора Мк, який сполучається з балоном краном Кр. Досліджуваним газом є повітря (рис. 1).
172
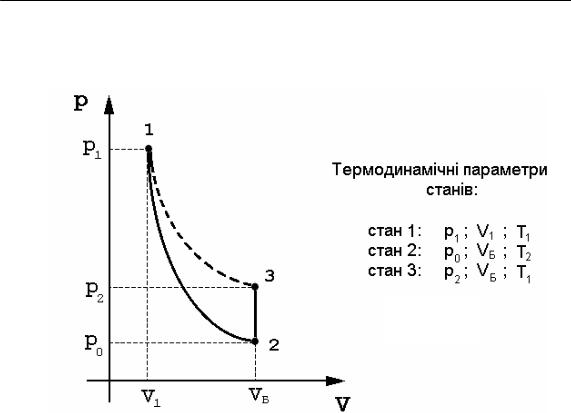
На початку досліду газ знаходиться у балоні при атмосферному тиску po і кімнатній температурі Т1, а під час експерименту послідовно проходить через 3 стани (рис. 2):
Рис. 2
Стан 1. Система перейде у стан 1, якщо при закритому корку К і відкритому крані Кр у балон мікрокомпресором нагнітати повітря до тиску
p1 = po + ρgh1. |
(1) |
Надлишковий над атмосферним тиск |
ρgh1 визначають у |
міліметрах водяного стовпа (h1 – виміряна в мм різниця рівнів води у колінах манометра).
Стан 2. Якщо повністю відкрити корок К, повітря з балону буде швидко розширюватися в атмосферу до вирівнювання тиску у балоні з атмосферним. Цей процес можна приблизно вважати адіабатним, він супроводжується охолодженням повітря до температури Т2< Т1. Газ, що залишився у балоні займав до розширення деяку частину об’єму балона V1 < VБ, після розширення його об’єм дорівнює VБ. Перехід газу із стану 1 в стан 2 ілюструє крива 1–2 (адіабата).
Стан 3. Якщо закрити балон, газ у ньому внаслідок теплообміну буде ізохорно нагріватися до кімнатної температури Т1, при цьому
тиск зросте до значення |
|
p2 = po + ρgh2 . |
(2) |
Перехід газу із стану 2 в стан 3 ілюструє крива 2–3 (ізохора).
173
Інструкції до лабораторних робіт
Зауважимо, що стани 1 і 3 відповідають одній температурі Т, тобто і одній ізотермі (крива 1–3), тому згідно з законом Бойля– Маріотта:
p1V1 = p2VБ. |
(3) |
Адіабатне розширеня 1–2 опишемо рівнянням Пуассона: |
|
|
p Vγ |
= p Vγ . |
|
(4) |
1 1 |
|
0 Б |
|
|
Поділимо рівняння (3) у степені γ на рівняння (4) |
|
|
p1γ V1γ |
= |
p2γ VБγ |
, |
(5) |
p1V1γ |
|
|
p0 VБγ |
|
|
звідки випливає:
æ p öγ ç 1 ÷ çè p2 ÷ø
Пролоґарифмувавши (6), знайдемо γ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
æ |
|
ö |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ç |
p1 |
÷ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
lnç |
|
÷ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
γ= |
|
|
è p0 ø |
. |
|
|
|
|
|
|
|
|
|
(7) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
æ |
|
ö |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ç |
p1 |
÷ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
lnç |
|
÷ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
è p2 ø |
|
|
|
|
|
|
|
|
Перетворимо знаменник (7), |
додавши і віднявши lnp0, а також |
підставимо значення p1 і p2 з формул (1), (2): |
|
|
|
|
|
|
|
|
|
ln |
p1 |
|
|
|
|
|
|
|
|
|
ln |
p0 + ρgh1 |
|
|
|
|
|
|
|
p0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
γ = |
|
|
|
|
|
|
|
= |
|
|
|
|
|
|
|
|
|
p0 |
|
|
|
|
|
. |
(8) |
|
p |
1 |
|
|
|
|
p |
2 |
|
|
p |
0 |
+ ρgh |
|
p |
0 |
+ ρgh |
|
|
ln |
|
|
- ln |
|
|
ln |
|
1 |
|
- ln |
|
|
2 |
|
|
|
p0 |
p0 |
|
|
|
p0 |
|
|
p0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Атмосферний |
|
тиск |
po |
>> |
ρgh1; |
ρgh2, |
отже |
|
|
|
ρgh1 << 1; |
ρgh2 << 1, тому, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p0 |
використовуючи наближення |
ln(1+x) |
≈ x, з (8) |
p0
матимемо:
174

|
|
ρgh1 |
|
|
|
h1 |
|
γ = |
|
|
p0 |
|
|
|
, або γ = |
|
|
|
|
|
. |
(9) |
ρgh1 |
− |
ρgh2 |
h1 − h2 |
|
p0 |
|
p0 |
|
|
|
|
Отже, для знаходження |
|
γ треба експериментально визначити |
h1 та h2.
При підготовці до виконання роботи використати: Теоретична частина. Розділ 7.2, 7.3, 7.4.
Послідовність виконання роботи
1.У закритий корком К балон Б при відкритому крані Кр нагнітають повітря мікрокомпресором Мк до створення різниці рівнів води у манометрі не менше 150–200 мм.
2.Закрити кран Кр. Внаслідок стиску температура повітря у балоні дещо підвищиться, тому необхідно почекати 2–3 хв, поки темпе-ратура зрівняється з кімнатною, і різниця рівнів води у манометрі перестане змінюватися. Записати h1 у таблицю.
3.Відкрити корок К і швидко закрити його після припинення характерного шипіння стисненого повітря, що розширюється в атмосферу. При цьому тиск у балоні зрівняється з атмосферним, рівні води у манометрі стануть однаковими, а температура газу знизиться.
4.Почекати декілька хвилин, поки повітря у балоні нагріється до кімнатної температури; тиск повітря при цьому зросте. Після встановлення постійної різниці рівнів води у манометрі записати h2.
5.За формулою (9) обчислити γ.
6.Дії, зазначені у пунктах 1–5, повторити 10 разів. Визначити похибки вимірювань.
175
Інструкції до лабораторних робіт
Таблиця результатів вимірювань і розрахунків
№ |
h1, мм |
h2, мм |
γ |
γ |
δγ |
1 |
вимір. |
вимір. |
розр. |
розр. |
|
2 |
вимір. |
вимір. |
розр. |
розр. |
|
3 |
вимір. |
вимір. |
розр. |
розр. |
|
. |
. |
. |
. |
. |
|
. |
. |
. |
. |
. |
|
. |
. |
. |
. |
. |
|
10 |
вимір. |
вимір. |
розр. |
розр. |
|
сер. |
|
|
розр. |
розр. |
розр. |
Контрольні запитання
1.Що називається молярною теплоємністю?
2.Вивести рівняння Майєра і пояснити, чому CP>CV.
3.Який процес називається адіабатним, яким закономірностям він підлягає?
4.Чому при адіабатному розширенні газ охолоджується?
5.Записати і пояснити рівняння Пуасcона.
6.Чим визначається величина γ?
7.У чому полягає фізичний зміст універсальної газової сталої R?
8.Вивести розрахункову формулу для визначення γ методом Клемана–Дезорма.
Рекомендована література
1.Курс фізики / За ред. І.Є. Лопатинського. – Львів: Вид-во “Бескид Біт”, 2002.
2.Трофимова Т.И. Курс физики. – М.: Высш. шк., 1990.
3.Савельев И.В. Курс общей физики. Т. 1. – М.: Наука, 1982.
176
Лабораторна робота № 31
ВИЗНАЧЕННЯ ЗМІНИ ЕНТРОПІЇ ПРИ НАГРІВАННІ І ПЛАВЛЕННІ СПЛАВУ ОЛОВА
177
Інструкції до лабораторних робіт
Мета роботи
Використовуючи експериментально визначену температуру плавлення сплаву олова, розрахувати зміну ентропії в процесах нагрівання і плавлення сплаву.
Прилади і матеріали
Вимірювальний пристрій, термометр, секундомір.
Опис вимірювального пристрою
Складовими частинами вимірювального пристрою є:
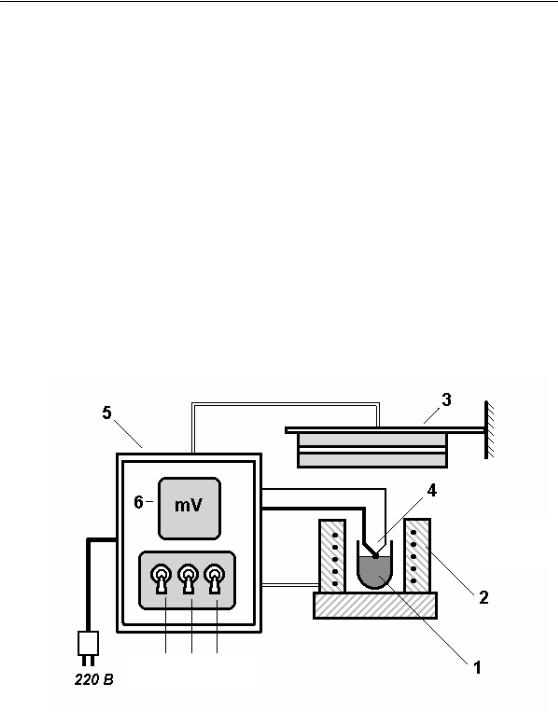
Рис. 1
вб а
(1)– тиґель зі сплавом олова, вміщений в електричний нагрівач (2);
(3)– вентилятор для охолодження розплаву;
(4)– термопара для контролю за температурою сплаву.
Термопара, вентилятор і електричний нагрівач під’єднані до блоку
(5), на передній панелі якого містяться:
(6)– мілівольтметр – для вимірювання термо ЕРС термопари (E, мВ) і вимикачі:
(а) – для ввімкнення блока в електричну мережу; (б) – для ввімкнення електричного нагрівача; (в) – для ввімкнення вентилятора.
178
Лабораторна робота №31
Виведення розрахункової формули
Кількість теплоти, необхідна для нагрівання сплаву олова від кімнатної температури ТК до температури плавлення Тпл, визначається як:
|
|
|
|
|
Tпл |
|
|
|
|
|
|
|
|
Q1 = òcMdT, |
|
|
|
|
(1) |
|
|
|
|
|
TK |
|
|
|
|
|
|
де с – питома теплоємність сплаву, |
|
|
|
|
|
|
М – маса сплаву |
|
|
|
|
|
|
|
|
|
|
|
Кількість теплоти, необхідна для плавлення сплаву: |
|
|
|
|
Q2 = λ М, |
|
|
|
|
(2) |
|
де λ − питома теплота плавлення. |
|
|
|
|
|
|
Зміна ентропії при здійсненні цих процесів: |
|
|
|
|
Tпл |
|
dT |
|
λМ |
|
Tпл |
|
λМ |
|
|
|
S = ò |
cМ |
+ |
= сМ ln |
+ |
. |
(3) |
|
|
|
|
|
|
TK |
|
T |
Tпл |
TK |
Tпл |
|
При підготовці до виконання роботи використати: Теоретична частина. Розділ 7.2, 7.5.
Послідовність виконання роботи
1.Перевести всі вимикачі в положення “вниз” .
2.Визначити і записати у першу колонку таблиці початковий
показ мілівольтметра Е0, який відповідає початковій температурі сплаву ТК.
3.Під’єднати блок (5) до електричної мережі і ввімкнути вимикач (а) ( мережа).
4.Ввімкнути вимикач (в) (нагрів) і через кожні 2 хв записувати покази мілівольтметра. Після досягнення термо ЕРС значення 4 мВ покази мілівольтметра записувати через кожні 0,5 хв. Нагрівати до t ≈ 150 °C .
5.Після повного розплавлення сплаву вимкнути вимикач (в) (нагрів), ввімкнути вимикач (б) (вентилятор) і також через кожні 0,5 хв записувати в таблицю покази мілівольтметра, поки температура сплаву не понизиться до t ≈ 70 °C.
6.Використавши таблицю ґрадуювання термопари (Додаток 3), визначити відповідні температури і побудувати ґрафіки залежності температури сплаву Т від часу t для процесів нагрівання і охолодження.
179
Інструкції до лабораторних робіт
7.Визначити температуру плавлення Тпл, яка дорівнює температурі кристалізації. (вказані температури визначаються горизонтальними ділянками ґрафіків Т(t), оскільки процеси плавлення і кристалізації – ізотермічні і температура деякий часпостійна).
8.За формулою (3) визначити зміну ентропії.
9.Розрахувати абсолютну і відносну похибки.
маса сплаву М = (6,5 ± 0,05)10-3 кг,
питома теплоємність сплаву с = (230 ± 0,5) Дж/(кг К), питома теплота плавлення сплаву λ = ( 58,6 ± 0,05)103 Дж/кг.
Таблиця результатів вимірювань
t, хв |
вимір. |
вимір. |
вимір. |
вимір. |
вимір. |
вимір. |
вимір. |
ð |
|
Е, мВ |
вимір. |
вимір. |
вимір. |
вимір. |
вимір. |
вимір. |
вимір. |
ð |
|
° |
табл. |
табл. |
табл. |
табл. |
табл. |
табл. |
табл. |
ð |
|
t, C |
|
|
|
|
|
|
|
|
|
|
T, К |
розр. |
розр. |
розр. |
розр. |
розр. |
розр. |
розр. |
ð |
|
|
|
|
|
|
|
|
|
|
|
t, хв |
|
|
|
|
|
|
|
|
вимір. |
вимір. |
вимір. |
вимір. |
вимір. |
вимір. |
вимір. |
ð |
|
Е, мВ |
вимір. |
вимір. |
вимір. |
вимір |
вимір. |
вимір. |
вимір. |
ð |
|
° |
табл. |
табл. |
табл. |
табл. |
табл. |
табл. |
табл. |
ð |
|
t, C |
|
|
|
|
|
|
|
|
|
|
T, К |
розр. |
розр. |
розр. |
розр. |
розр. |
розр. |
розр. |
ð |
|
|
|
|
|
|
|
|
|
|
|
Контрольні запитання
1.Сформулювати перший закон термодинаміки.
2.Сформулювати другий закон термодинаміки.
3.Пояснити фізичний зміст ентропії.
4.Вивести формулу для визначення зміни ентропії при нагріванні і подальшому плавленні сплаву олова.
Рекомендована література
1.Курс фізики / За ред. І.Є. Лопатинського. – Львів: Вид-во “Бескид Біт”, 2002.
2.Трофимова Т.И. Курс физики. – М.: Высш. шк., 1990.
3.Савельев И.В. Курс общей физики. Т. 1. – М.: Наука, 1982.
180