
obobwmju
.pdf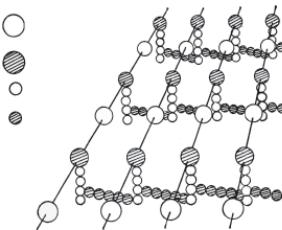
середовищем, захист від несприятливих зовнішніх впливів, здатність до адсорбції вірусів бактерій, участь в реакціях імуні- тету.
Основним компонентом клітинної стінки бактерій є пептидо- глікан, або муреїн (лат. mureus — стінка). Скелет пептидогліка- ну складається з паралельно розміщених молекул глікану (амі- носахаридів), які складаються із залишків N-ацетилглюкозамі- ну і N-ацетилмурамової кислоти, зв’язаних між собою глюко- зидними зв’язками (рис. 2.6). Гліканові молекули зв’язані бічни- ми і поперечними пептидними містками, звідси і назва полімеру
— пептидоглікан. Бічні ланцюжки представлені тетрапептида- ми, поперечні — пентапептидами. Склад пептидних ланцюжків ідентичний для певного пептидоглікану, але у різних видів бак- терій вони різні. У складі цих ланцюжків виявлено лише 4 із по- ширених амінокислот: глутамінова кислота, лізин, аланін і гліцин. Також до складу пептидоглікану входять унікальні амі- нокислоти: мезодіамінопімелінова, виявлена тільки у прокаріот, D-ізомери глутамінової кислоти та аланіну.
Отже, за компонентами і структурою клітинної стінки бак- терії докорінно відрізняються від тварин і рослин. Тому лікарські препарати, які специфічно впливають тільки на бактеріальні стінки і процес їхнього синтезу, мають бути нешкідливими для вищих організмів.
Завдяки поперечним зв’язкам пептидоглікан набуває струк- тури молекулярної сітки, утворюючи величезного розміру ригід- ну мішкоподібну макромолекулу, навколишню бактеріальну
N-ацетилглюкозамін
N-ацетилмура- мова кислота
Пептидний
ланцюжок
Пентаглі- циновий місток
Рис. 2.6. Схема загальної структу- ри пептидоглікану (муреїну)
49
клітину. Міцність клітинної стінки значна, витримує колосаль- ний осмотичний тиск (у кишкової палички — близько 15 атм). Клітинна стінка інертна до дії хімічних речовин, має низьку сприй- нятливість до барвників. Її можна виявити при спеціальному за- барвленні, електронній мікроскопії, а також у темному полі зору, після плазмолізу.
Це явище полягає в такому. Якщо вмістити бактеріальні кліти- ни у гіпертонічний розчин, то за рахунок виходу води цитоплаз- ма стиснеться і разом із цитоплазматичною мембраною від- ділиться від клітинної стінки. Внаслідок плазмолізу клітини ги- нуть. Це використовується для консервування харчових про- дуктів за допомогою концентрованих розчинів кухонної солі або цукру. Однак деякі бактерії стійкі до плазмолізу, наприклад, Staphylococcus aureus, що може призвести до харчових отруєнь.
Оскільки склад і будова клітинної стінки є одними з найваж- ливіших диференціальних ознак бактерій, необхідно на цьому детальніше зупинитися. Бактерії, що мають клітинну стінку, за- лежно від її структури поділяються на фірмікути (товстошкірі) і грацилікути (тонкошкірі). Інакше їх можна ще поділити на грам- позитивні і грамнегативні — за здатністю забарвлюватися за методом Грама.
Клітинна стінкагрампозитивних бактерій має однорідну струк- туру (рис. 2.7). Її товщина значно більша, ніж у грамнегативних бактерій (20–60 нм). Основна маса стінки — це пептидоглікан, на його частку припадає до 90 % сухої маси клітинної стінки. Він може складатися з 5–40 шарів, а не 1–2, як у грамнегативних бактерій. На відміну від грамнегативних бактерій, у складі клітин- ної стінки грампозитивних бактерій містяться тейхоєві кислоти (грец. teichos — стінка) — розчинні у воді лінійні полімери із залишків гліцерину або рибітолу. Тейхоєві кислоти є основними поверхневими антигенами багатьох грампозитивних бактерій, вони виступають назовні через пори пептидоглікану.
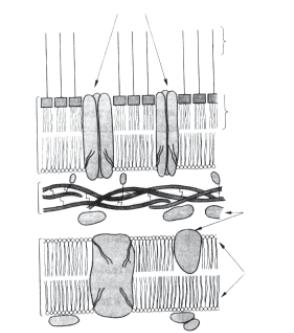
Клітинна стінкаграмнегативних бактерій (рис 2.8) значно тон- ша (14–18 нм), здебільшого наявний один (рідко — два) шар пеп- тидоглікану, це не більше 10 % сухої маси клітинної стінки. Для пептидоглікану грамнегативних бактерій характерний низький вміст поперечних зв’язок. У клітинній стінці відсутні тейхоєві кислоти, міститься багато ліпопротеїдів, фосфоліпідів,ліпополі- сахаридів, більше білка.
Клітинна стінка грамнегативних бактерій має більш складну внутрішню структуру, ніж у грампозитивних. На цитоплазма-
50

тичній мембрані міститься од- ношаровий муреїновий мішок, до якого щільно прилягає зовні-
шня мембрана, зв’язана з муреї-
новим шаром ліпопротеїнами. Ліпопротеїни орієнтовані свої- ми ліпофільними кінцями на- зовні і закріплені в ліпофільно- му подвійному шарі зовнішньої мембрани. Подвійний ліпідний шар зовнішньої мембрани скла- дається з ліпіду А, полісаха- ридів і фосфоліпідів. У цьому шарі знаходяться гідрофобні кінці ліпополісахаридів, гід- рофільні кінці яких обернені назовні. Полісахаридна части- на ліпополісахаридів має анти- генні властивості і є О-антиге- ном грамнегативних бактерій. О-антиген має дуже велике зна- чення в діагностиці й ідентифі- кації бактерій. Ліпополісаха- рид більшості бактерій токсич- ний, він є ендотоксином, от- руйність якого визначається ліпідом А зовнішньої мембра- ни.
У подвійний ліпідний шар зовнішньої мембрани вбудовані білки, що пронизують його
наскрізь. Ці трансмембранні білки являють собою заповнені во- дою канали — гідрофільні пори в ліпофільній мембрані (пори- ни). Вони пропускають через мембрану гідрофільні низькомоле- кулярні речовини з молекулярною масою менше 6000 Д.
Муреїновий шар, мабуть, є легко проникним для багатьох ре- човин. Проміжок між муреїном і цитоплазматичною мембраною називають периплазматичним простором. У ньому містяться біл- ки, в тому числі й деполімерази, периферичні білки цитоплазма- тичної мембрани і так звані зв’язувальні білки, які беруть участь у переносі деяких речовин у цитоплазму.
51
Порини
Ліпополісахарид
простір |
Зовнішня мембрана 8 нм |
Периплазматичний |
Клітинна стінка 2–3 нм |
Цитоплазматична мембрана 8 нм |
О-антиген
Ліпід А
Ліпопротеїн
Муреїн
Білки
Фосфоліпіди
Рис. 2.8. Модель структури клітинної стінки грамнегативних бак- терій (Г. Шлегель, 1987)
При обробці грампозитивних бактерій ферментами, що руй- нують пептидоглікан (наприклад, лізоцимом), виникають прото- пласти, тобто структури, повністю позбавлені клітинної стінки. Незалежно від форми вихідних клітин бактерій, протопласти зав- жди набувають сферичної форми. Це є доказом того, що клітин- на стінка визначає форму бактерій. У протопластах відбувають- ся основні процеси життєдіяльності, але вони не здатні ресинте- зувати клітинну стінку, рідко діляться. За деяких умов (наприк- лад, у 30%-му желатині) в протопластах може індукуватися ре- генерація клітинної стінки і вони реверсують у вихідну клітинну форму. Однак це відбувається дуже рідко, найчастіше прото- пласти відмирають.
Сферопластами називають бактерійні клітини, частково поз- бавлені клітинної стінки. Вони виявляються у старих культурах, а також у разі дії пеніциліну, що порушує синтез клітинної стінки, обробки лізоцимом грамнегативних бактерій, при якій руйнуєть-
52

ся тільки пептидоглікановий шар, а зовнішня мембрана збері- гається. Сферопласти відрізняються від протопластів тим, що можуть розмножуватися, легко реверсувати у вихідну бактерій- ну форму. Протопласти і сферопласти можуть існувати тільки в ізотонічних і гіпертонічних розчинах, у гіпотонічних розчинах вони легко розриваються.
Порушення синтезу клітинної стінки є основою L-трансфор- мації бактерій.
Ззовні клітинної стінки всі бактерії оточені слизовим шаром (рис. 2.3), який захищає клітини від висихання. Слизовий шар має різну товщину і конфігурацію, його межі не чіткі. За допомо- гою фібрилярних полісахаридних структур слизу здійснюється зв’язок між сусідніми клітинами в колонії бактерій, а також при- кріплення бактерій до різних субстратів. Якщо слизовий шар досить товстий, міцний і оформлений, його називають капсулою.
Морфологічно розрізняють дватипикапсул: мікрокапсули(тов- щинаменше0,2 мкм, виявляютьсятількиприелектронніймікроско- пії у вигляді шару мукополісахаридних фібрил) і макрокапсули (товщина більше 0,2 мкм, добре помітні при світловій мікроскопії).
Більшість патогенних бактерій формують в організмі людини і тварин мікрокапсули, які захищають їх від чинників резистент- ності організму. Макрокапсули (рис. 2.9), або власне капсули,
Рис. 2.9. Капсули бактерій (за Л. Месро- бяну, Е. Пеунеску, 1963). Забарвлення за Буррі. × 3750
53
формують лише деякі бактерії. Для деяких патогенних бактерій характерне утворення капсул тільки в макроорганізмі (стрепто- коки пневмонії, збудники сибірки, чуми тощо). У деяких бактерій капсула формується і в організмі, і при зростанні на живильних середовищах (лебсієли пневмонії, озени, риносклероми). Більшість капсул складається зі складних полісахаридів, капсу- ли деяких хвороботворних бактерій (збудника сибірки) — з полі- сахаридів і поліпептидів, що містять переважно L- і D-глутамі- нові кислоти. Оскільки D-амінокислоти стійкі до протеаз, така капсула краще захищає бактерії від фагоцитозу. Хімічний склад і антигенні властивості речовини капсул є специфічними для бак- терій, що дозволяє ідентифікувати бактерії за родом, видом і сероваром.
Капсула і слизовий шар не є життєво необхідними компонен- тами бактерійної клітини. Однак капсула оберігає клітину від механічних ушкоджень, висихання, створює додатковий осмо- тичний бар’єр, перешкоджає проникненню токсичних речовин і бактеріофагів всередину клітини. Капсула захищає патогенні бактерії від чинників резистентності макроорганізму — фагоци- тозу, комплементу тощо.
Капсула належить до зовнішніх (надоболонкових) структур клітини.
До них належать також придатки, які об’єднуються під за- гальною назвою пілі. Будова і функції пілей різні, у однієї кліти- ни можуть бути наявні пілі різної природи.
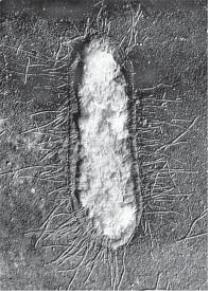
Мікроворсинки або фімбрії (лат. fimbriae — нитка, бахрома,
волокно) — білкові волоски (від 10 до кількох тисяч на одній клітині), товщина яких дорівнює 3–25 нм, а довжина — переваж- но 0,3–1 мкм, зрідка 4 мкм і більше (рис. 2.10). Вони розпочина- ються у цитоплазматичній мембрані і пронизують клітинну стінку, звичайно не зігнуті хвилеподібно. Вони утворені білком піліном, молекули якого формують спіралеподібну нитку. Їх основна функ- ція — прикріплення бактерій до субстрату, вони є фактором ко- лонізації. Наприклад, ворсинки кишкової палички забезпечують прикріплення до епітелію слизової оболонки кишечнику, гоно- кока — до епітелію урогенітального тракту. Крім того, за раху- нок фімбрій збільшується поверхня бактерійної клітини, що кон- тактує з живильним середовищем, через фімбрії деякі поживні речовини можуть надходити всередину клітини.
F-пілі (статеві ворсини, секс-пілі, донорські ворсини) звичайно існують у невеликій кількості (1–2 на клітину), товщиною 8–35 нм,
54
довжиною 0,5–10 мкм. Ці вор- сини також розпочинаються у цитоплазматичній мембрані, де відбувається синтез білка піліну, з якого вони побудовані. Формуються F-пілі тільки в ак- тивно зростаючій клітині про- тягом 4–5 хв, стільки ж часу зберігаються на її поверхні, потім скидаються. Вони слугу- ють для кон’югації — з їхньою допомогою встановлюється контакт між клітиною-донором і клітиною-реципієнтом і відбу- вається передача ДНК.
Інші варіанти зовнішніх |
|
структур (типу шипиків і стеб- |
|
линок) у патогенних бактерій |
|
вивчені недостатньо. |
|
Джгутики (війки) є органом |
Рис. 2.10. Пілі Klebsiella pneu- |
руху бактерій. Багато патоген- |
moniae (за Л. Месробяну, Е. Пе- |
них бактерій нерухомі, джгу- |
унеску, 1963). × 29 000 |
тиків не мають. Рухливі бак- |
|
терії пересуваються за допомогою джгутиків. За кількістю і роз- міщенням джгутиків (рис. 2.11) бактерії розділяють на монотри- хи (з одним полярно розміщеним джгутиком, наприклад, холер- ний вібріон), лофотрихи (з пучком джгутиків на одному полюсі
— деякі представники роду Pseudomonas), амфітрихи (з одним джгутиком або пучком їх на обох полюсах — Spirillum minus), перитрихи (з великою кількістю джгутиків — від кількох десятків до 1000, розміщених по всій поверхні клітини, — ентеробактерії, протей, клостридії правця).
Джгутики — це тонкі спіральні нитки товщиною 10–20 нм і довжиною 3–20 мкм. Вони складаються з білка флагеліну (лат. flagellum — батіг), побудовані з його субодиниць з молекуляр- ною масою 20–60 кД. Флагелін має антигенну специфічність (Н- антигенний). За структурою він схожий з міозином м’язових клітин.
Ультраструктура джгутиків вивчена детально (рис. 2.12). Вони складаються з трьох частин: описаної вище спіральної нитки, гачка поблизу поверхні клітини і базального тільця. Базальне
55
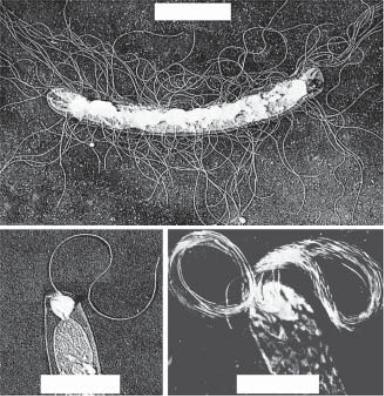
тільце складається з центрального стриженя, на якому в грам- негативних бактерій знаходяться дві пари кілець. Зовнішня пара кілець міститься в муреїновому шарі і зовнішній мембрані, одне з кілець внутрішньої пари — в цитоплазматичній мембрані, дру- ге — на внутрішній поверхні пептидогліканового шару. Оскіль- ки у грампозитивних бактерій зовнішня пара кілець відсутня, вважають, що для обертання джгутиків необхідна тільки внутріш- ня пара кілець. Конструкція джгутика виконує функцію флагелі- нового мотора, в якому розміщене у цитоплазматичній мемб- рані кільце внутрішньої пари діє як привідний диск, а друге кільце цієї пари відіграє роль підшипника.
Перитрих
Монотрих Лофотрих
Рис. 2.11. Джгутики бактерій на електронограмах (за Л. Месро- бяну, Е. Пеунеску, 1963)
56
|
Гачок |
Зовнішня |
|
мембрана |
|
Муреїн |
Базальне тільце |
Цитоплазматична |
Стрижень |
|
|
мембрана |
|
Рис. 2.12. Схема джгутикового апарата у Escherichia coli (за Topley & Wilson’s Principles of bacteriology, virology and immunity, 1990)
Більшість бактерій у середньому за секунду проходять відстань, близьку до довжини їхнього тіла. Швидше рухаються бактерії з полярним розміщенням джгутиків — монотрихи і ло- фотрихи. Наприклад, холерний вібріон при довжині тіла не більше 2 мкм може рухатися зі швидкістю понад 100 мкм/с.
Рухливі бактерії здатні до таксису (грец. taxis — розташуван- ня, розміщення) — направленого руху, що визначається зовні- шніми факторами. Залежно від них розрізняють хемо-, аеро-, фото-, магнітотаксис. Здатність до цілеспрямованого руху регулюєть- ся генетично, наприклад, у Escherichia coli у цей процес залуче- но до 3 % геному (близько 50 генів).
Рухливість бактерій має диференціальне значення і дослі- джується при мікроскопії роздушеної краплі в темному полі зору або за допомогою фазово-контрастної мікроскопії. Існують та- кож культуральні способи виявлення рухливості.
Оскільки товщина джгутиків значно менша роздільної здат- ності світлового мікроскопа, їх вивчають при електронній мікроскопії або за допомогою спеціальних методів забарвлен- ня, що дозволяє збільшити товщину джгутиків (наприклад, сріблення).
57

4.ТИНКТОРІАЛЬНІ ВЛАСТИВОСТІ БАКТЕРІЙ
Бактерійні клітини напівпрозорі, слабо заломлюють світло, тому при звичайних методах мікроскопії в незабарвленому стані їх складно виявити. Для виявлення бактерій у нативних препара- тах використовують мікроскопію в темному полі зору, фазово- контрастну і аноптральну мікроскопію, а також мікроскопію у звичайному світловому мікроскопі з опущеним конденсором. Однак ці методи дослідження є недостатньо інформативними і обмежено застосовуються під час мікробіологічної діагностики. Набагато ефективнішим є мікроскопічне вивчення заздалегідь убитих, а потім забарвлених бактерій. У мікробіології для за- барвлення мікроскопічних препаратів найчастіше застосовують анілінові барвники.
Припростому забарвленні застосовують один барвник, складні методи забарвлення потребують застосування кількох барвників й інших речовин у кілька етапів. Просте забарвлення зручне для оглядової мікроскопії, виявлення форми і взаєморозміщення бак- терій. Складні методи забарвлення дозволяють виявити тонкі деталі будови бактерій, провести цитохімічні дослідження для виявлення хімічних компонентів бактерійної клітини.
Розробка і використання методів забарвлення дозволили де- тально вивчити морфологію бактерій, виявити структурні еле- менти, що мають диференціальне значення і важливі для іденти- фікації бактерій, вивчити відмінності між бактеріями щодо здат- ності сприймати барвники, яка визначає так звані тинкторіальні властивості бактерій.
Тинкторіальні властивості бактерій (лат. tinctura, від tingo —
забарвлюю) — здатність до забарвлення: сприйнятливість до забарвлення, кислото-спирто-лугостійкість, рівномірність забарв- лення, метахроматичність, відношення до забарвлення за мето- дом Грама.
Сприйнятливість до забарвлення у більшості видів бактерій ви-
сока, вони легко і швидко його сприймають. Як правило, перед забарвленням бактерії фіксують у полум’ї або хімічними фіксато- рами, внаслідок чого вони гинуть і краще сприймають барвники. При забарвленні в живому стані ферментні системи бактерій мо- жутьруйнуватиізнебарвлюватибарвник, томуприжиттєве(віталь- не) забарвлення рідко застосовують у мікробіології.
58
