
Биофизика 02
.pdf
Розділ 4. БУДОВА ТА ВЛАСТИВОСТI БIОЛОГIЧНИХ МЕМБРАН
Біофізика мембран вивчає структуру біологічних мембран, транспорт речовин через них, генерацію і поширення нервового імпульсу, процеси рецепції і перетворення енергії, більшість яких здійснюються на біомембранах.
Біологічні мембрани виконують в організмі безліч функцій: вони обмежують клітину (так звані цитоплазматичні мембрани або плазмалема) і клітинні органели, розділяючи таким чином клітину на окремі області (компартменти), що дозволяє підтримувати нерівноважний стан організму, формують міжклітинні контакти, забезпечують механічний захист клітин, вибірковий регульований транспорт речовин, проведення нервового імпульсу, беруть участь у синтезі АТФ, забезпечують оптимальне розташування в просторі мембранних білків, що здійснюють ферментативні реакції, роботу рецепторів, імунної системи.
Даний розділ біофізики для фармації особливо важливий. У першу чергу це зв’язано з тим, що ефективність ліків залежить від швидкості їхнього проникнення в ту або іншу тканину, що, у свою чергу, визначається проникністю для них біологічних мембран. Крім того, дія багатьох ліків спрямована на зміну проникності мембран для деяких речовин або інших властивостей мембран. Так як багато патологічних процесів, дія фізичних і хімічних факторів у першу чергу відбивається на мембранах, то її вивчення знайшло широке застосування в медичній діагностиці.
§ 20. Структура мембран
На даний час загальновизнаною є запропонована в 1971 р. Ніколсоном і Сінгером рідинноFмозаїчна модель (рис. 4.1), відповідно до якої основу мембран складає подвійний шар ліпідів. Ліпіди біомембран представлені переважно фосфоліпідами. Ці сполуки складаються з гліцерину або сфінгозину, до першого атома вуглецю яких приєднана фосфорна кислота, а один або два інших етерифіковані залишками жирних кислот. Фосфорна кислота, крім того, зв’язана з полярною сполукою (холіном, етаноламіном, серином та ін.). Молекула лецитину, або фосфатидилхоліну (рис. 4.2) має у своєму складі одну позитивно й одну негативно заряджену групу і тому є диполем. Деякі інші фосфоліпіди мають один
81

Рис. 4.1. Схема будови біологічної мембрани: 1 — гідрофільні головки ліпідів; 2 — гідрофобні «хвости» ліпідів; 3 — гідрофільна ліпідна пора; 4 — інтегральні білки; 5 — вуглеводна компонента гліколіпіду; 6 — мікротрубочка, що утримує білок; 7 — білковий канал;
8 — периферичні білки.
позитивний і два негативних заряди.
Ліпіди біологічних мембран мають властивість амфіфільності1 (або амфіпатичності), тому що складаються з полярної гідрофільної “головки” і неполярного гідрофобного “хвоста” (рис. 4.2), які відносяться один до одного по довжині приблизно як 1:4. Завдяки такій будові у водному (полярному) оточенні ліпіди прагнуть розташуватися таким чином, щоб неполярні хвости контактували один з одним, але не з водою, а полярні головки, навпаки, — з водою. Тому ліпіди в гідрофільному середовищі спонтанно формують подвійний шар (бішар): усередині виявляються гідрофобні ділянки, а зовні — гідрофільні. Така організація ліпідних молекул відповідає стану з найменшою енергією Гіббса. Біліпідний шар, що утворився, не має країв, а прагне замкнутися на себе. Так, наприклад, утворюються ліпосоми (див. нижче).
Подібне суворе просторове розташування молекул у мембрані визначає багато в чому її фізичні властивості. Мембрани мають високий питомий електричний опір (порядку 107 Ом·м2) і високу питому ємність (приблизно 0,5·10–2 Ф/м2). Діелектрична проникність мембранних
Рис. 4.2. Лецитин (фосфатидилхолін).
1 Амфіфільність – у перекладі з грецького означає «люблячий обох».
82

ліпідів дорівнює 2.
Більшість фосфоліпідів мають два жирнокислотні залишки. Форма таких ліпідів близька до циліндра. Якщо ж у ліпіду одна з двох жирних кислот відсутня, наприклад, у результаті перекисного окислення ліпідів або дії деяких фосфоліпаз, то молекула нагадує конус. У водяному розчині такі ліпіди утворюють міцели (рис. 4.3), а в мембрані — гідрофільні пори (рис. 4.1). Через останні здатні проходити деякі речовини (наприклад, іони), для яких у нормі проникність мембрани вкрай мала. Зміна проникності мембрани може привести до патології. Іонізуюче випромінювання (ультрафіолетове, рентгенівське і γFвипромінювання) підсилює
процеси перекисного окислення ліпідів, а, отже, |
|
сприяє утворенню пор. Це є одним з механізмів |
|
поразки клітини при впливі випромінювання. |
|
Мембрани містять значну кулькість різних |
|
білків. Їхня кількість така велика, що поверхневий |
|
натяг мембрани ближче до величини поверхневого |
|
натягу на межі розділу білок—вода (σ ~ 10–4 Н/м), |
|
ніж ліпід–вода (σ~ 10–2 Н/м). Концентрація мем- |
|
бранних білків залежить від виду клітини. Напри- |
|
клад, у мієліновій мембрані аксонів мозку людини |
Рис. 4.3. Міцела. |
білків у 5 разів менше, ніж ліпідів, а у внутрішній мембрані мітохондрій печінки, навпаки, білків у 4 рази більше. Одні
білки знаходяться на поверхні мембрани (периферичні білки), інші частково занурені в ліпідний шар або пронизують мембрану наскрізь (інтегральні білки).
Інтегральні білки, так само як і ліпіди, мають властивість амфіфільності: та частина білка, що знаходиться в мембрані, складається з гідрофобних амінокислот, звичайно скручених в αFспіраль, інша частина, що виступає з мембрани, складається з гідрофільних амінокислот. Інтегральні білки утримуються в мембрані завдяки гідрофобним взаємодіям, а крім них іноді і молекулами цитоскелета — мікротрубочками і мікрофіламентами (рис. 4.1). Досить часто до кінця інтегрального білка, що виступає в позаклітинне середовище, приєднані вуглеводи. Ці комплекси, які називають глікопептидами, часто є рецепторами, грають важливу роль в імунних реакціях організму.
Прикладами інтегральних білків є білок фоторецепторних мембран
— бактеріородопсин, який пронизує мембрану сім разів, білок еритроцитів — глікофорин, до поліпептидного ланцюга якого можуть бути приєднані різні олігосахариди. Глікофорини визначають групи крові людини АВ0. Багато інтегральних білків утворюють канали, через які можуть проходити водорозчинні молекули та іони. У цьому випадку внутрішня частина каналу містить гідрофільні радикали амінокислот.
Периферичні білки можуть знаходитися як із внутрішнього, так і з зовнішнього боку мембрани. Як правило, вони зв’язані з мембраною
83

електростатичними взаємодіями, тобто набагато слабкіше, ніж інтегральні білки. Тому багато периферичних білків легко вилучаються з мембрани.
Вуглеводи (як правило, у вигляді гліколіпідів і глікопротеїнів) в основному містяться в глікокаліксі1 тваринних клітин і клітинній стінці рослинних клітин і бактерій. Ці структури примикають до ліпідного бішару. Питома частка вуглеводів у біомембранах, як правило, складає не більше 10–15%.
Товщина біологічних мембран дорівнює 5–10 нм, однак, незважаючи на це, їхня частка в сухій масі клітин перевищує 50%. Це пояснюється тим, що компоненти мембран упаковані дуже щільно, а також тим, що сумарна площа цитоплазматичних і внутрішньоклітинних мембран дуже велика.
Всі природні мембрани асиметричні, тобто однакові молекули ліпідів та білків знаходяться на зовнішній і внутрішній поверхнях мембрани в різних концентраціях. Ліпіди цих двох поверхонь відрізняються, як правило, своїми гідрофільними головками. Асиметрія мембран зокрема сприяє тому, що транспорт речовин здійснюється тільки в якомусь одному напрямку. Вуглеводні компоненти мембранних глікопротеїнів знаходяться тільки зовні клітини,щозабезпечуєміжклітиннерозпізнавання,взаємодіюмембранних рецепторів з гормонами та іншими фізіологічно активними речовинами. З внутрішнього боку мембрани розташовані цитоплазматичні ферменти та компоненти, які забезпечують закріплення цитоскелета.
Мембранні ліпіди і білки мають велику рухливість, тобто здатні дифундувати внаслідок теплового руху. Якщо переміщення молекул відбувається в межах одного мембранного шару, то такий процес називається латеральною дифузією, якщо ж молекула переходить з одного шару в інший, то — “фліпFфлоп”Fперехід.
Частота перескоків молекул унаслідок латеральної дифузії ν дорівнює:
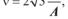 (4.1) де D — коефіцієнт латеральної дифузії; А — площа, яку займає одна молекула на мембрані. Час осілого життя τ молекули в одному положенні обернено пропорційний частоті перескоків:
(4.1) де D — коефіцієнт латеральної дифузії; А — площа, яку займає одна молекула на мембрані. Час осілого життя τ молекули в одному положенні обернено пропорційний частоті перескоків:
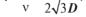 (4.2) При цьому середнє квадратичне переміщення молекул за час t скла-
(4.2) При цьому середнє квадратичне переміщення молекул за час t скла-
дає:
(4.3)
1 Глікокалікс – глікозамінгліканова (мукополісахаридна) поверхнева оболонка клітини.
84

Дифузія ліпідів дуже велика. Наприклад, ліпіди мембран саркоплазматичного ретикулума при температурі 40 °С мають коефіцієнт дифузії, 1,2·10–11 м2/с. Якщо А = 7·10–19 м2, то молекули за одну секунду роблять 5,9·107 перескоків, тоді час осілого життя ліпіду складає 1,7·10–8 с. Для молекул яєчного лецитину Sкв =5мкм, тобто за одну секунду кожна молекула здатна оббігти навколо такої клітини як E. coli1. Ліпіди, що знаходяться поблизу молекул білків у межах двохFтрьох діаметрів ліпідної молекули, дифундують із трохи меншою швидкістю, ніж вільні ліпіди.
Молекули білків також досить швидко переміщаються, хоча і повільніше, ніж ліпіди. Так, білкові молекули антигенів лімфоцитарної мембрани мають D =10–14 м2/с, Sкв =0,2 мкм. Рухливість багатьох мембранних білків буває різко обмежена мікротрубочками або мікрофіламентами, що утримують білки у певному місці на мембрані.
Крім поступального руху мембранні молекули роблять ще й обертальний. Молекули фосфоліпідів повертаються на 1 радіан за 10–9 с, родопсин — за 10–6 с, цитохромоксидаза — за 10–4 с.
У порівнянні з латеральною дифузією “фліпFфлоп”Fпереходи відбуваються за набагато порядків менший час. Середній час переходу молекул фосфоліпіду з однієї поверхні мембрани на іншу не перевищує однієї години. Молекули білків майже не зазнають таких переходів за рідкими винятками.
Великі різниці між швидкостями латеральної дифузії і “фліпFфлоп”Fпереходами дуже важливі. Настільки швидка латеральна дифузія забезпечує високу швидкість хімічних реакцій, які відбуваються на мембранах, а мала імовірність “фліпFфлоп”Fпереходу сприяє збереженню асиметрії мембран.
§ 21. Штучні мембранні структури
Для вивчення багатьох властивостей мембран, таких як проникність для різних речовин (у тому числі і ліків), електропровідність, механізми формування трансмембранних потенціалів та ін., буває зручніше використовувати не природні, а штучні мембрани. Останніх існує декілька видів.
Відомо, що ліпіди, нанесені на поверхню води, не змішуються з нею, а утворюють плівку. При нанесенні деякої кількості ліпідів на поверхню води можна одержати мономолекулярний шар. Завдяки властивості амфіфільності, на межі поділу вода–повітря гідрофільні головки ліпідів звернені до води, а гідрофобні хвости — у повітря.
Такі мономолекулярні шари зручно використовувати для вивчення механічних властивостей мембран, рухливості й упакування мембран- них молекул, усіляких процесів, що протікають на межі поділу фаз, дії
1 Escherichia coli – кишкова паличка.
85

ліків. Відомо, що деякі фізичні (наприклад, зміна температури) і хімічні (наприклад, дія деяких анестетиків) впливи здатні змінити площу, що займається однією молекулою фосфоліпіда. Моношари дозволяють відносно нескладними методами виміряти цю величину. Їх готують не тільки зі штучних ліпідів, але і з ліпідів природних мембран як здорових, так і патологічних клітин, що дозволяє проводити ряд біологічних і медичних досліджень.
На спроможності ліпідів утворювати мономолекулярні шари на межі поділу гідрофобної і гідрофільної фаз заснована дія миючих засобів. Мило складається з ліпідних молекул, які у воді оточують засалені ділянки поверхні, що відмивається. Гідрофобні шматочки бруду виявляються усередині капсули, оточеної моношаром із молекул мила. Зовні така капсула має гідрофільні групи і тому легко змивається водою.
Моношари мають істотний недолік: вони являють собою один шар ліпідів, у той час як природні мембрани утворені двома шарами. Цим недоліком не володіють такі штучні мембранні структури як ліпосоми і плоскі бішарові ліпідні мембрани.
Ліпосоми (рис. 4.4) утворюються при додаванні в полярний розчин фосфоліпідів. При цьому відбувається спонтанне формування бішарових замкнутих структур, тому що тільки такий стан вигідний для амфіфільних частинок у полярному розчині. Як правило, спонтанно утворюються багатошарові (мультиламелярні) ліпосоми, у котрих кожний ліпідний бішар відділений від іншого шаром води. Товщина біліпідних шарів складає 6,5–7,5 нм, у залежності від природи ліпідів. Моношарові (моноламелярні) ліпосоми можна одержати при дії на емульсію з багатошаровими ліпосомами ультразвуком. Ліпосоми, отримані цим методом, не дуже зручні для досліджень, тому що занадто малі (діаметр 20–40 нм). В даний час існують методи для одержання ліпосом більшого розміру (діаметром до 400 нм і більше). Ліпосоми можуть утворювати і природні
мембрани при дії на них руйнуючих чинників (ультразвук, механічні впливи).
До складу мембрани ліпосом крім ліпідів можуть бути включені білки, а також невеликі фрагменти природних мембран. Ліпосоми, що містять білки, називаються протеоліпосомами. Ліпосоми дозволяють, змінюючи ліпідний і білковий склад, змоделювати цитоплазматичну, мітохондріальну мембрани, мембрани ендоплазматичного ретикулума та інших органел клітини. За допомогою ліпосом можна визначити проникність мембрани для того або іншого
лікарського препарату. Для цього ліпосоми одержують у розчині, що
86

містить досліджуваний препарат. Частина препарату виявляється усередині ліпосом, а частину, що залишилася, виводять із навколишнього розчину. Тоді по кількості препарату, що просочується із ліпосом у розчин за певний період часу, визначають швидкість його виходу, а отже
— проникність мембрани для нього.
Ліпосоми можна використовувати не тільки в наукових дослідженнях, але і на практиці. Якщо усередину ліпосоми ввести лікарський препарат, то може полегшитися його доставка і проникнення в потрібні тканину або орган. Склад ліпосомальних ліпідів можна підібрати таким чином, що така оболонка буде цілком не токсична. У косметології, наприклад, до складу кремів включають ліпосоми, що містять біологічно активні речовини. Розглядається можливість введення інсуліну за допомогою ліпосом. Біліпідна оболонка здатна захистити білкову молекулу інсуліну від дії ферментів травного тракту. Це дозволить вводити інсулін перорально, а не за допомогою ін’єкцій.
Іноді потрібно доставити препарат саме в даний орган або певну ділянку органа. Відомо, що кожний клас клітин організму має на своїй мембрані серед численних білків характерні білки (антигени), властиві тільки цим клітинам. До кожного антигену існує комплементарна молекула (антитіло), здатна взаємодіяти тільки зі «своїм» антигеном. Якщо таке антитіло включити в біліпідну оболонку ліпосоми, то, випадково опинившись (із током крові) біля потрібного антигену, до клітини прикріпиться антитіло, а з ним — і ліпосома з ліками. Однак, подібні методи терапії ще остаточно не розроблені.
Плоскі бішарові ліпідні мембрани (БЛМ) можна одержати, якщо на невеликий отвір діаметром біля 1 мм у тонкій фторопластовій пластині, розміщеній у воді, нанести краплю вуглеводневого (наприклад, гептанового) розчину ліпіду. Розчинник дифундує в розчин, утворюється товста ліпідна плівка, що спонтанно стоншується протягом 5–20 хв. доти, поки не утвориться біліпідна мембрана товщиною 5–7 нм (рис. 4.5). Стоншенню плівки сприяють сили поверхневого натягу і сили ВанFдерFВаальса, що притягають шари води з обох боків плівки. Зайві ліпідні молекули збираються на ободку отвору в пластиковій склянці, створюючи торус.
В БЛМ, також як і в ліпосоми, можна включити білки, наприклад, ті, що формують білковий канал для якогось іона, та інші мембранні компоненти, що робить БЛМ добрим об’єктом для вивчення електричних, транспортних та інших властивостей мембран. Наприклад, БЛМ допомогли вивчити дію антибіотиків валіноміцину і граміцидину, а також ряду інших лікарських препаратів, що змінюють проникність мембрани.
87
§ 22. Фазові переходи в мембранах
При нормальних фізіологічних умовах мембрани знаходяться в рідкому стані, однак на відміну від рідин, вони мають точно упорядковану просторову структуру. Завдяки таким властивостям стан мембран називають рідиннокристалічним.
За даними фізичних методів аналізу, таких як рентгеноструктурний
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
а |
|
б |
|
в |
||||||||
|
|
|
|
|||||||||||
Рис. 4.5. Утворення бішарової ліпідної мембрани:
а) комірка для одержання БЛМ і вивчення її електричних властивостей; б), в) послідовні етапи формування БЛМ.
1 – фторопластовий стаканчик; 2 – електроди; 3 – отвір у стінці стаканчика.
аналіз, мікрокалориметрія (вимір теплоємності) та інших, біологічні мембрани здатні випробувати фазовий перехід першого роду. Зі зниженням температури мембрани переходять із рідиннокристалічного стану у твердокристалічний (гельFстан).
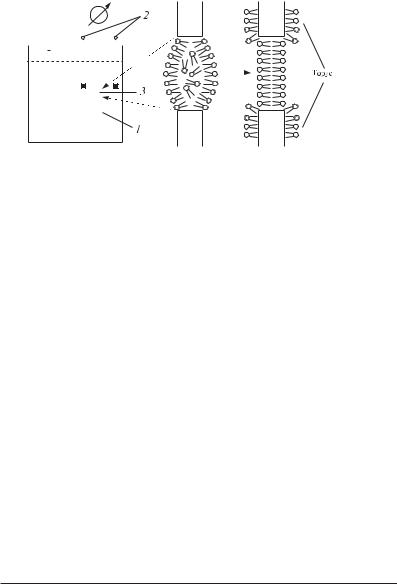
При такому переході зберігається загальна структура мембрани: ліпіди як і раніше утворюють подвійний шар із зверненими усередину гідрофобними хвостами, але порядок у системі ще більш зростає: хвости ліпідів витягнуті точно паралельно один до одного (рис. 4.6), їхні коливання обмежені. Якщо в рідкому стані площа мембрани, що приходиться на одну молекулу ліпіду, складає 0,58 нм2, то в гельFстані ця величина зменшується до 0,48 нм2. Товщина мембрани при переході в твердокристалічний стан збільшується, але за рахунок зменшення площі об’єм мембрани в цілому зменшується.
Рухливість ліпідних молекул в обох фазових станах сильно відрізняється. У гельFстані ліпіди здатні чинити лише спільні коливання або обертальні рухи. У рідкому стані ліпідні хвости мають набагато більшу свободу, особливо надто велика їхня рухливість усередині мембрани. Молекули ліпідів рідкої мембрани можуть знаходитися в двох конформаціях: у цілком трансF і в подвійній гошFконформації1 (гош[транс[гошFконфо
88
рмації), у гельFстані реалізується тільки трансFконформація (рис. 4.7). Довжина молекули в гошFконформації менша, ніж у транс, а ширина, навпаки, — більша. Цим пояснюється зменшення товщини і збільшення площі мембрани, що приходиться на один ліпід, при переході з гельF у рідиннокристалічний стан.
Рис. 4.6. Фазовий перехід мембранних ліпідів із рідиннокристалічного стану (а) у гель[стан
(б) при зниженні температури.
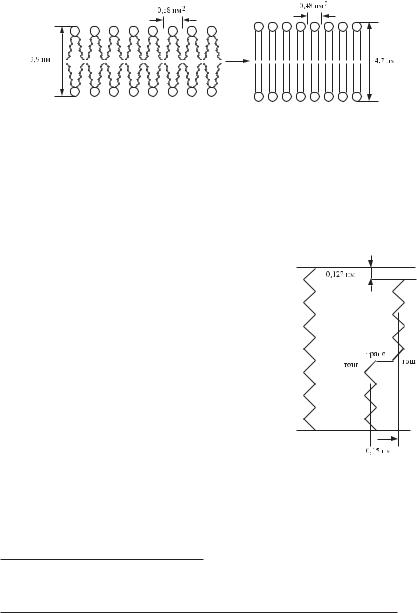
Здатність ліпідів рідиннокристалічної мембрани створювати гошFконформації сприяє підвищенню її проникності для деяких гідрофільних низькомолекулярних сполук, наприклад, води. Якщо дві сусідніх ділянки поруч розташованих молекул знаходяться в гошFконформації (рис. 4.8), то утворюється так званий кінк (від
англ. kink — петля). Кінки здатні переміщуватися уздовж ліпідних хвостів, і, якщо, між ними випадково виявилася невелика молекула, то вона може в такий спосіб пересікти гідро-
фобний шар. Останнім часом доведено (В.Ф. Антонов та
ін.), що при фазових переходах із рідиннокристалічного стану в гель і назад в мембранах утворюються пори діаметром 2–6 нм. Тобто при фазовому переході збільшується проникність
мембрани для іонів і низькомолекулярних сполук, тому що вони здатні проходити через такі пори. Далі буде показано, що проведення нервового імпульсу визначається зміною проникності мембрани для деяких іонів. Було висловлено припущення, що механізми терморе-
цепції (чутливість нервових клітинFрецепторів
до зміни температури), можливо, визначаються фазовим переходом у мембранах рецепторів, що сприяє виникненню нервового імпульсу. Так
1 Гош[конформація – поворот на ±120° відносно транс[конформації.
89
|
|
|
|
|
як фазовий перехід може мати і хімічну |
|
|
|
|
|
|
||
|
|
|
|
|
природу (наприклад, ліпіди мембрани |
|
|
|
|
|
|
||
Рис. 4.8. Перенос молекули А в резуль- |
можуть перейти в гельFстан внаслідок |
|||||
збільшення концентрації Са2+ від 1 до |
||||||
|
|
таті дифузії «кінка». |
||||
|
|
10 ммоль/л у міжклітинній рідині), |
||||
|
|
|
|
|
||
|
|
|
|
|
то, можливо, ці процеси визначають і |
|
хеморецепцію (чутливість до хімічних речовин).
Фазовий перехід у мембранах відбувається не миттєво, а протягом деякого температурного інтервалу. Температурою фазового переходу називається температура, при якій половина мембранних ліпідів знаходиться в рідиннокристалічному стані, а інша половина — у твердокристалічному.
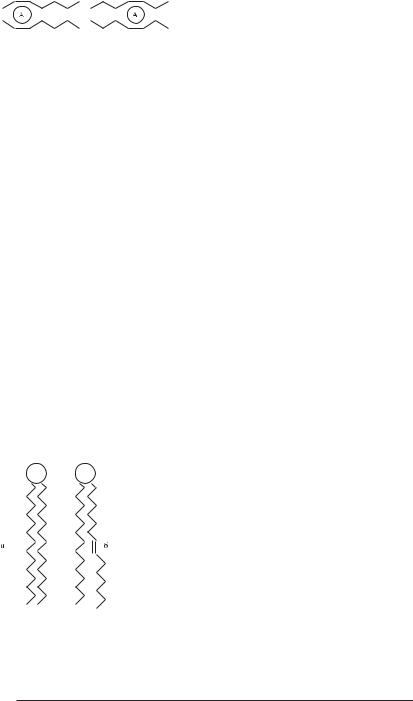
Температура фазового переходу залежить від ліпідного складу мембран: чим більше в хвостах ліпідів подвійних зв’язків (а їхнє число в одному хвості молекули може коливатися від нуля до чотирьох), тобто, чим більша ступінь ненасиченості жирнокислотних залишків, тим нижча температура фазового переходу. Для мембран, що складаються із насичених ліпідів, ця величина складає +60 °С, а для мембран із ненасичених ліпідів знижується до –20 °С. Така різниця в температурах плавлення пояснюється тим, що ненасичені жирні кислоти, які знаходяться в цисFконформації, сприяють видаленню одна від одної молекул ліпідів, а, отже зменшують сили зчеплення між ними (рис. 4.9). Чим слабше зв’язані між собою молекули, тим при більш низькій температурі мембрани переходять у рідку фазу.
Живі організми, що живуть у різних кліматичних умовах, мають різне співвідношення насичених і ненасичених зв’язків у молекулах ліпідів, що забезпечує їм пристосування до холоду або жари в залежності від їхнього середовища мешкання. Більш того, це співвідношення змінюється для різних ділянок тіла того самого організму. Наприклад, температура ноги біля копита полярного оленя може складати –20 °С, а температура ноги біля тулуба досягає +30 °С.
Однак, клітинні мембрани не зазнають фазо-
|
а |
|
б |
вого переходу за рахунок того, що мембрани |
|
|
|
|
|
|
|
|
|
|
|
|
клітин біля копита містять більше ненасичених |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ліпідів, а біля тулуба — більше насичених. Відо- |
|
|
|
|
|
|
|
|
|
|
|
мо, що тваринні жири при кімнатній темпера- |
|
|
|
|
|
турі знаходяться у твердому стані, а рослинні, |
|
|
|
|
|
навпаки, — у рідкому. Це пояснюється тим, |
Рис. 4.9. Цілком насичений |
що у тваринних клітинах менше ненасичених |
||||
ліпід (а) і ліпід, у якого один із |
ліпідів, ніж у рослинних. |
||||
жирнокислотних залишків є |
Фазові переходи мембранних ліпідів носять |
||||
|
|
ненасиченим (б). |
|||
90
