
Биофизика 02
.pdf
80, у той час як для більшості інших речовин менше 10.
Більшість вищеописаних анормальностей можна пояснити, припустивши у воді наявність зв’язків, що скріплюють між собою окремі молекули. Такими зв’язками є водневі зв’язки. Для того щоб зрозуміти, яким способом вода утворює розгалужену систему водневих зв’язків, розглянемо будову її молекули.
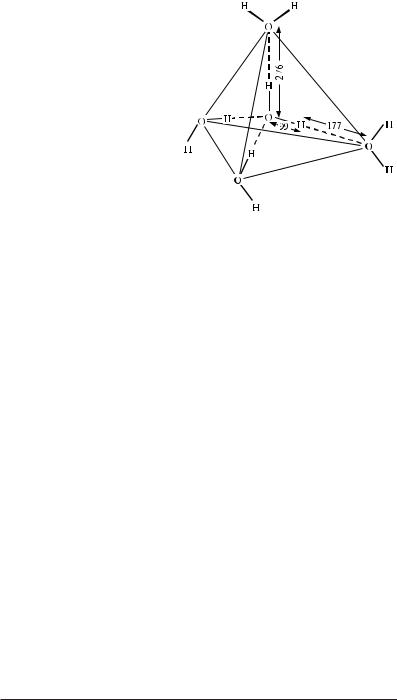
У молекулі води атоми розташовані нелінійно. Кут, утворений зв’язками О–Н один з одним, складає 104,5°. Атом кисню має на зовнішній оболонці чотири електрони, два з яких утворюють ковалентні зв’язки
здвома атомами водню. Електрони водню виявляються зміщеними убік атома кисню. Неподілена пара електронів кисню, у свою чергу, прагне віддалитися від електронів водню. Тому електронні орбіталі неподіленої пари сильно витягнуті в протилежний від водню бік, причому для того, щоб віддалитися на гранично максимальну відстань, площини орбіталей цих електронів розташовуються перпендикулярно площині Н–О–Н. У результаті атом кисню виявляється розташованим у центрі тетраедра, у двох вершинах якого знаходяться атоми водню. У напрямку до двох інших вершин тетраедра розташовуються орбіталі неподіленої електронної пари кисню. Ці електрони створюють локальний негативний заряд, у той час як атоми водню — позитивний. Завдяки такій будові молекула води є диполем із досить великим дипольним моментом1 (6·10–30 Кл·м).
Електронна структура води визначає її здатність виступати одночасно і донором, і акцептором при утворенні водневого зв’язку: два атоми водню однієї молекули зв’язуються з атомами кисню сусідніх молекул, а атом кисню даної молекули — із двома атомами водню інших молекул. Таким чином, кожна молекула води зв’язана водневими зв’язками
зчотирма сусідніми молекулами (рис. 3.1), тобто координаційне число води у твердій фазі дорівнює 4. Комплекси тетраедрів утворюють гексагональну кристалічну решітку льоду. Так як при цьому між молекулами залишається великий вільний простір, то лід має відносно низьку густину.
Що стосується структури рідкої води, то по цьому питанню немає єдиної думки. Під час плавлення кристалічна решітка частково руйнується і частина води виявляється незв’язаною. Однак, як показали дані рентгенографічного аналізу, у воді зберігаються ознаки упорядкованої структури.
Утворення упорядкованої структури води викликає зменшення ент-
ропії системи (∆S < 0), що термодинамічно невигідно. Однак це явище
1 Високе значення дипольного моменту молекул води пояснює велику діелектричну проникність цієї рідини. У рідкій воді диполі орієнтовані хаотично, і результатуюче електричне поле, створюване ними дорівнює нулю. В зовнішньому електричному полі диполі шикуються таким чином, щоб їхнє власне поле послабляло зовнішнє. Завдяки високому дипольному моменту молекул води зовнішнє поле послабляється в 80 разів.
51
супроводжується утворенням чотирьох водневих зв’язків, що приводить до зменшення ентальпії (∆H < 0), причому |∆H | > |T∆S |. Таким чином, повна зміна термодинамічного потенціалу Гіббса негативна:
∆G = ∆H – T∆S < 0,
тобто даний процес є енергетично вигідним.
Наявність водневих зв’язків |
|
|
|
у структурі льоду пояснює ви- |
|
|
|
|
|
|
|
соке значення питомої теплоти |
Рис. 3.1. Тетраедрична структура води. |
||
плавлення, а їхня присутність |
Відстані дані в пікометрах. |
||
у рідкій воді — її високі теп- |
|
|
|
лоємність і теплоту пароутворення, тому що руйнація водневих зв’язків, що відбувається під час плавлення льоду або нагрівання води, вимагає високих витрат енергії.
Відповідно до однієї з моделей, моделі мерехтливих кластерів, у воді є упорядковані області, подібні до структури льоду (кластери) і неупорядковані області, що представляють собою не зв’язані водневими зв’язками молекули (рис. 3.2). Кластери і неструктуровані області постійно обмінюються молекулами. Відповідно до розрахунків Г. Неметі і Х. Шерага, при температурі 20 °С частка молекул, об’єднаних у кластери, складає 70%, а вільних молекул — 30%. З підвищенням температури усе більше молекул переходить у незв’язаний стан, а середній розмір кластерів і їхня кількість зменшуються.
У кластерах не завжди зберігається правильна кристалічна решітка, властива льоду. Відповідно до моделі Самойлова, плавлення льоду, що супроводжується частковою руйнацією кристалічної решітки, приводить до того, що частина молекул, які втратили водневі зв’язки, розташовується в порожнинах тетраедрів, які формують кристалічну решітку. Розмір тетраедрів такий, що в їхніх порожнинах може розміститися одна молекула води, не руйнуючи і не зачіпаючи водневих зв’язків, які формують цей тетраедр. Це пояснює підвищення густини води при плавленні льоду. Однак із підвищенням температури зростає теплова енергія молекул, і отже, збільшується амплітуда їхніх коливань, що зменшує густину води. При температурі нижче 4 °С переважає перший фактор (заповнення порожнин решітки), а при більш високих температурах — другий (збільшення амплітуди коливань), тобто максимальна густина води досягається при температурі 4 °С.
52
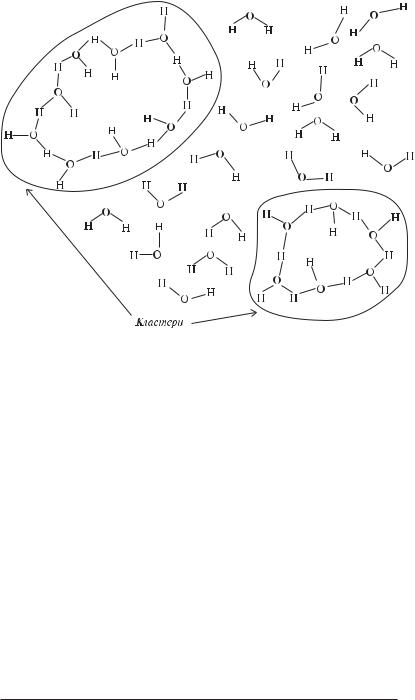
Рис. 3.2. Модель мерехтливих кластерів для рідкої води.
При порушеннях правильної гексагональної структури води збільшується число навколишніх сусідів даної молекули. Тому координаційне число води в рідкій фазі вище, чим у кристалічної, і дорівнює 4,4.
Молекули води, знаходячись у вузлах кристалічної решітки або створюючи упорядковану структуру в рідкій воді, роблять коливання навколо положення рівноваги з періодом τкол ≈ 2·10–13 с і обертання (τоб ≈ 10–5 с для льоду і 10–11 с для води). Якщо час спостереження τ набагато менше часу коливальної дифузії, то виникає миттєва або МFструктура, за умови τкіл <<τ<<τвр — коливальноFусереднена або КFструктура, при τ >> τвр — дифузійноFусереднена або ДFструктура (рис. 3.3). Молекули здатні робити і трансляційні переходи, але в кристалі їхня частота дуже мала, а в рідкому стані вже значна, тому ДFструктура рідкої води розмита.
Навколо розчинених у воді макромолекул і іонів утворюється так звана сольватна, або гідратна оболонка. Властивості води, яка утворює цю оболонку, відрізняються від властивостей звичайної води. Так, середній час осілого життя молекули збільшується в декілька разів.
У залежності від ступеню розчинності у воді, розрізняють гідрофільні
53

і гідрофобні сполуки. Для кількісного опису гідрофільності або гідрофобності сполуки використовують величину зміни термодинамічного потенціалу Гіббса ∆G при переносі сполуки з неполярного розчинника в полярний, наприклад, з етанолу у воду. Чим менша величина ∆G, тим краща розчинність сполуки. Гідрофільними, як правило, є полярні сполуки, а гідрофобними — неполярні. Однак є деякі винятки. Наприклад, полярна амінокислота аргінін і неполярна аланін мають однакове
а |
б |
в |
Рис. 3.3. Структура води: а) миттєва; б) коливально[усереднена; в) дифузійно[усереднена.
значення ∆G (3070 Дж/моль), за рахунок того, що до складу аргініну входить великий вуглеводневий залишок.
Якісна картина взаємодії розчинених речовин із водою полягає в наступному. Навколо розчиненої сполуки середній час осілого життя молекул води збільшується, частка молекул, що утворює упорядковані області зростає в порівнянні з їх долею в решті розчину. У результаті ентропія системи зменшується (∆S <0). Утворення більшого числа водневих зв’язків знижує ентальпію системи (∆Н <0), але у випадку розчинення неполярних сполук у воді |∆H |<|T∆S |, тобто
∆G = ∆H – T∆S > 0,
що і визначає енергетичну невигідність цього процесу.
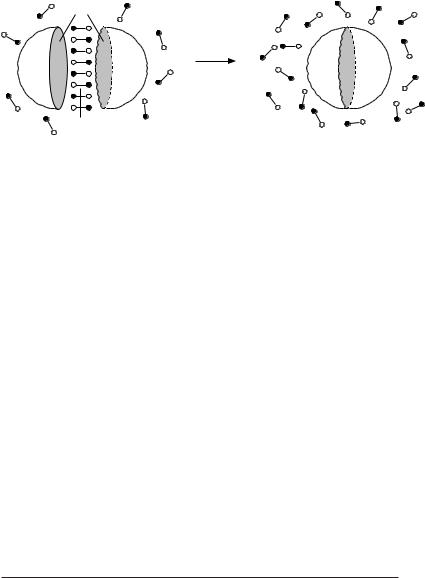
Неполярні сполуки виштовхуються з водяного оточення й асоціюються одна з одною (рис. 3.4). Такі взаємодії називаються гідрофобними. З вищесказаного випливає, що ці взаємодії виникають не в силу якихось специфічних сил притягання між неполярними сполуками, а цілком визначаються властивостями води.
§ 16. Структура і властивості біополімерів
54
Структура макромолекул має кілька рівнів організації. Первинною структурою називають послідовність мономерів, що утворюють полімерний ланцюг, у білках це — послідовність амінокислот, у нуклеїнових кислотах — нуклеотидів. Первинна структура стабілізована ковалентними зв’язками, у той час як всі інші рівні організації — в основному слабкими взаємодіями (водневими, гідрофобними, електростатичними й ін.). Під вторинною структурою розуміють регулярне розташування
3
1 |
2 |
|
4
Рис. 3.4. Схематичне зображення виникнення гідрофобних взаємодій. 1, 2 – молекули з неполярними ділянками 3; 4 – упорядкована ділянка води.
в просторі елементів ланцюга, наприклад, вторинна структура нуклеїнових кислот являє собою спіраль. Третинною структурою називають взаємне розташування в просторі регулярних і нерегулярних елементів ланцюга, хоча насправді різниця між вторинною і третинною структурою є умовною. Деякі макромолекули складаються із кількох ланцюгів, називаних субодиницями. Взаємне розташування субодиниць називається четвертинною структурою біополімеру.
Для полімерів, синтезованих у живому організмі характерна властивість хіральності. Більшість складних органічних молекул асиметричні, тобто не мають ні площини, ні центру симетрії. Такі молекули існують у двох формах — правої і лівої, і є дзеркальним відбитком одна одної. Термін “хіральність” походить від давньогрецького слова “хейр”
— рука, тому що наші долоні також є дзеркальноFсиметричними. Ліву і праву форми однієї молекули, що звичайно називають стереоізомерами, не можна сполучити одну з одною ніяким поворотом системи як цілого в просторі (так, наприклад, праву рукавичку не можна надягти на ліву руку).
У природі звичайно приходиться зустрічатися з асиметричним атомом вуглецю (у хімічних формулах він позначається зірочкою). Такий атом зв’язаний із чотирма різними групами (С*XYZV). Якщо хоча б дві групи з чотирьох є однаковими, то така молекула має площину симетрії, тобто не є хіральною. Так у молекулі СХ2YZ такою площиною є площина СYZ. Хіральними є всі амінокислоти (крім гліцину), вуглеводи, нуклеї-
55
нові кислоти. Однак азотисті основи такою властивістю не володіють, тому хіральність нуклеїнових кислот визначається вуглеводною компонентою.
Фізичною стороною хіральності є здатність розчину одного стереоізомера обертати площину поляризації плоскополяризованого світла. Одні стереоізомери обертають площину поляризації вліво (проти годинникової стрілки), вони називаються лівообертовими і перед ними ставлять знак “–“, інші обертають площину поляризації вправо і називаються правообертовими “+“. Розчин, що складається з одного стереоізомера хіральної сполуки, є оптично активним, тобто здатним обертати площину поляризації. Суміш двох стереоізомерів оптичною активністю не володіє.
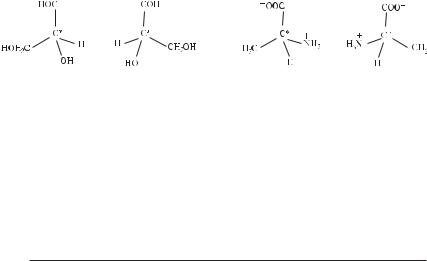
Звичайно стереоізомери розрізняють не за напрямком обертання площини поляризації, а, порівнюючи з деяким еталоном, яким є гліцеральдегід (рис. 3.5).
У лабораторних умовах неможливо одержати речовину, що складається з одного стереоізомера. Отриманий розчин буде містити 50% лівого ізомера і 50% правого, тобто буде рацемічною сумішшю. Таке співвідношення відповідає максимальній ентропії. Стереоізомери мають однакову хімічну активність, однак у живій природі хіральні сполуки існують звичайно в якійсь одній формі. Організм розрізняє LF і DFізомери при поглинанні ззовні (так деякі сполуки є отруйними в одній конфігурації і нешкідливими в іншій; фармпрепарат фенамін у LFформі надає у 25 разів більший вплив на рухову активність мишей, ніж у DFформі) і синтезує сполуки в одній стереоконфігурації. У клітині амінокислоти присутні в LFформі, а вуглеводи в DFформі.
Навколо одинарних атомних зв’язків у молекулі можливе обертання. За допомогою фізичних методів дослідження (зокрема, спектроскопії і
а |
б |
в |
г |
Рис. 3.5. Різні конфігурації гліцеральдегіду й аланіну: а) D[гліцеральдегід;
б) L[гліцеральдегід; в) D[аланін; г) L[аланін.
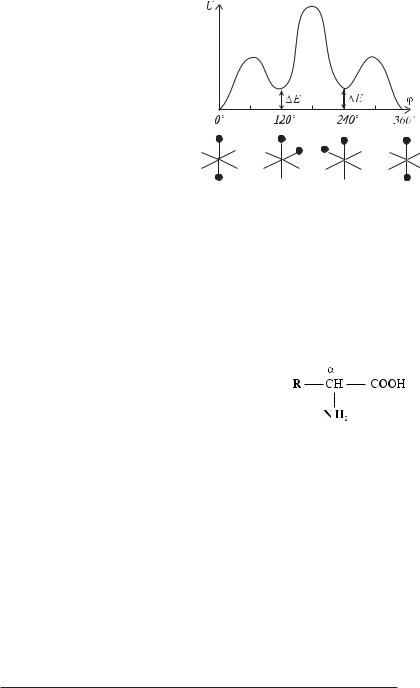
ЯМР) було встановлено, що не всі значення кутів повороту рівноімовірні. Так у молекулі етану найбільше ймовірні значення кутів повороту однієї групи СН3 щодо другої, кратні 120°. У цьому випадку молекула знаходиться в трансFконформації (рис. 3.6,а). Кути, що відповідають цисFконформації (60°, 180° і 300°, рис. 3.6,б), найменш імовірні. Залежність енергії етану та інших молекул, що мають осьову симетрію С3, приблизно визначається в такий спосіб:
56
U = 1/2U0(1 – cos 3ϕ), |
(3.4) |
де U0 — висота потенційного бар’єра між двома трансFконформаціями (для етану U0 = 12,5 кДж/моль). Графічно залежність U(ϕ) приведена на рисунку 3.7.
Причини, по яких трансFконформація є більш вигідною, ніж цисF, мають квантовомеханічну природу і полягають в відштовхуванні близько розташованих валентно не зв’язаних атомів (у даному випадку атомів водню однієї групи СН3 від атомів  водню другої групи СН3), а також
водню другої групи СН3), а також  у взаємодіях зв’язків, що примика-
у взаємодіях зв’язків, що примика- 


 ють до осі обертання (так званий
ють до осі обертання (так званий 
 ефект орієнтації зв’язків).
ефект орієнтації зв’язків). 
Енергія взаємодії залежить |
|
|
|
від відстані r між атомами і ви- |
а |
б |
|
значається співвідношенням сил |
|||
|
|
відштовхування і притягання. |
Рис. 3.6. Молекули етану в транс[ (а) і цис[ |
Як випливає з (3.1), (3.2) і (3.3), |
(б) конформації (проекції надані на площину, |
енергія притягання, обумовлена |
яка перпендикулярна |
орієнтаційними, індукційними |
С–С[зв’язку). |
і дисперсійними взаємодіями, |
|
обернено пропорційна r6. На близьких відстанях стає значною енергія відштовхування, обернено пропорційна r12. Тому повну енергію ванFдерFваальсових взаємодій можна представити у вигляді:
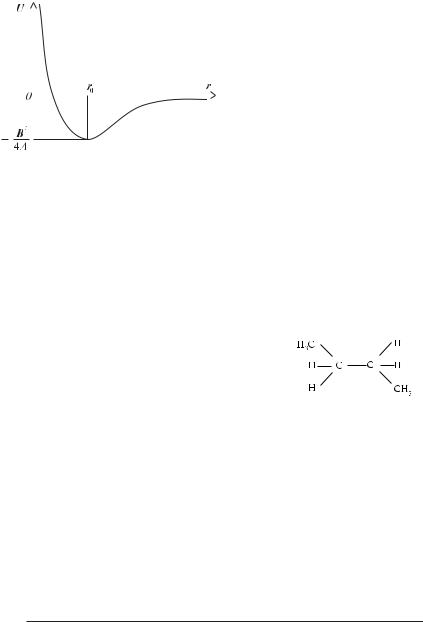
де U(r) — потенціал “6–12” ЛеннардFДжонса; А і В — константи, певні для зв’язків між різними атомами. На рисунку 3.8 приведений вигляд відповідної кривої.
Продиференціювавши вираз U(r), можна одержати значення відстані r0, на якій енергія взаємодії мінімальна, тобто система знаходиться в рівновазі
r0 = (2А/В)1/6, тоді мінімальна енергія складає 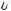
Для молекул, що не мають коаксіальну симетрію, залежність внутрішньої енергії від кута повороту навколо одинарного зв’язку приймає більш складний
Рис. 3.7. Залежність потенційної енергії U від кута повороту ϕ для етану.
57
характер, ніж у рівнянні (3.4).
Наприклад, внутрішня енергія для нFбутану (рис. 3.9) в залежності від кута повороту навколо зв’язку між двома групами С2Н5, також як і для
етану, має три мінімуми (рис. 3.10). Однак ці мінімуми мають неоднакову |
|||
|
|
|
глибину. Це пояснюється тим, |
|
|
|
що для молекули етану всі три |
|
|
|
|
|
|
|
можливі трансFконформації |
|
|
|
однакові, у той час як для бутану |
|
|
|
вони відрізняються. На рисун- |
|
|
|
ку 3.10 схематично подані три |
|
|
|
найбільш вигідні конформа- |
|
|
|
ції нFбутану. Найбільш глибо- |
|
|
|
кий мінімум енергії відповідає |
|
|
|
трансFконформації, а два інших |
Рис. |
|
|
— так званим згорнутим або |
3.8. Залежність потенційної енергії взає- |
|||
модії від міжмолекулярної відстані. |
гошFконформаціям. |
||
Вигідні конформації, що виникають при поворотах навколо одинарних зв’язків називають поворотними ізомерами. Молекула буде переходити з однієї вигідної конформації в іншу зі швидкістю, що визначається висотою потенційного бар’єра, який відокремлює ці конформації. Так, при висоті потенційного бар’єра біля 12,5 кДж/моль, час перетворення одного поворотного ізомера в інший складає 10–10 с. Тому суміш поворотних ізомерів не можна розділити.
Макромолекули володіють кількома видами ізомерії. Різні ізомери тієї самої сполуки, перехід між якими можливий тільки за умови розриву
й утворення нових ковалентних зв’язків, назива- |
|
ються конфігураціями цієї сполуки. Прикладом |
|
конфігурацій служать LF і DFізомери. Якщо ж |
|
перехід з одного ізомера в інший здійснюється за |
|
рахунок повороту навколо одинарних ковалент- |
|
них зв’язків без їхнього розриву, то такі ізомери |
Рис. 3.9. нFбутан. |
називаються конформаціями. |
|
§ 17. Структура білків
У складі природних білків зустрічаються 20 аміно - к и с л о т . В с і в о н и є п о х і д н и м и к а р б о н о в и х к и с л о т , у яких до атому ву глецю, що знаходиться в αFположенні (рис. 3.11), приєднана аміногрупа (–NH2).
Як видно з загальної формули (рис. 3.11), амінокислоти відрізняються одна від одної радикалом R, що може містити аліфатичні, ароматичні, гідроксильні, карбоксильні групи і включати атоми азоту, водню, кис-
58
ню, водню і сірки. Формування білкового ланцюга з кількох амінокислот відбувається шляхом утворення ковалентного пептидного зв’язку (рис. 3.12). Ланцюг із кількох амінокислот називається поліпептидом. Певна послідовність амінокислот у ланцюзі складає первинну структуру білка.
При утворенні пептидного зв’язку зв’язок N–C набуває
частково подвійний характер |
Рис. 3.10. Залежність внутрішньої енергії (U) |
(його довжина складає 0,132 |
від кута повороту (ϕ) для н[бутану і його кон- |
нм, що менше довжини одинар- формацій, що відповідають мінімуму потенцій-
ної енергії (суцільними лініями позначені зв’язки
ного зв’язку і більше довжини |
найближчої групи С |
Н |
, штриховими – далекої |
подвійного зв’язку), а зв’язок |
2 |
5 |
|
групи, чорними кружками позначені групи СН3, |
|||
С=О — частково одинарний |
проекції дані на площину, перпендикулярну |
||
(при цьому його довжина збіль- |
центральному С–С[ зв’язку). |
|
|
шується від 0,121 нм до 0,124 |
|
нм). Внаслідок спряження зв’язків N–C і С=О обертання навколо N–CFзв’язку неможливо і всі чотири атоми, що беруть участь в утворенні пептидного зв’язку, лежать в одній площині.
Існування безлічі конформацій макромолекул забезпечується можливістю обертання навко-
ло зв’язків С–Сα (на кут ψ) і Cα–N (на кут ϕ)
(рис. 3.13). Не всі значення кутів ϕ і ψ припус- Рис. 3.11. α[Амінокислота.
тимі внаслідок можливої стеричної невідповідності двох сусідніх амінокислотних залишків. Індійський
учений Г. Рамачандран розрахував припустимі значення кутів ϕ і ψ(кути відраховуються від плоскої трансFконформації поліпептидного ланцюга) і побудував стеричні карти, на яких по осі абсцис відкладаються значення кутів ϕ від 0° до 360°, а по осі ординат — значення кутів ψ. На карті відзначаються цілком дозволені (при звичайних міжатомних відстанях) і частково дозволені (при мінімальних міжатомних відстанях) області значень цих кутів (рис. 3.14).
Молекули білків прагнуть знаходитися в стані з мінімальною внутрішньою енергією. Це досягається за рахунок стабілізації хімічних груп у просторі водневими зв’язками. У такий спосіб утворюється деяка упорядкована система, що називається вторинною структурою білка.
59
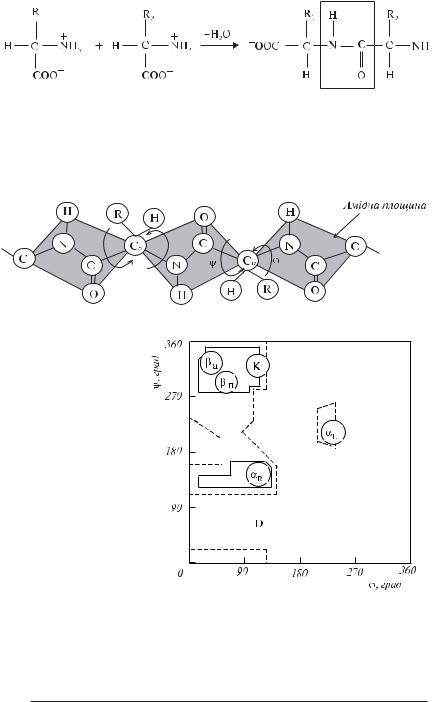
Рис. 3.12. Утворення пептидного зв’язку (позначено пунктиром).
Як установили Полінг і Корі, поліпептидні ланцюги можуть утворювати спіральні і складчасті структури.
αFспіралі бувають лівозакрученими (ϕ=228°, ψ=237°) і правозакрученими (ϕ=132°, ψ=123°). Водневі зв’язки, що стабілізують таку структуру, утворюються між групою С=О i[ї амінокислоти і групою NFH (i+4)Fї
Рис. 3.13. Розташування пептидних груп білкової молекули.
амінокислоти (рис. 3.15). Кожний мономер повертається навколо осі спіралі на 100° і переміщається уздовж осі на 0,15 нм. Таким чином, на кожний виток спіралі приходиться 3,6 пептидних одиниці, а довжина витка складає 0,54 нм. Існують спіральні структури з параметрами, відмінними від наведених вище, наприклад, колагенова спіраль. Деякі спіралі закручуються одна навколо іншої, створюючи суперспіральні структури, наприклад, у білках тропоміозин і
Рис. 3.14. Стерична карта для полі[L[аланіну.
Суцільні лінії позначають межі цілком дозволених областей, пунктирні – частково дозволених. На карті вказані області значень кутів ϕ і ψ для паралельної (βп) і антипаралельної (βа) β[форм, спіралі білка колагену (К), правої (αR) і лівої (αL) α[спіралей.
60
