
- •Фізична та колоїдна хімія
- •Фізична хімія
- •Тема 1. Хімічна термодінамика
- •Тема 2. Хімічна кінетика та рівновага. Каталіз
- •Тема 3. Розчини
- •Тема 4. Електрохімія
- •Колоїдна хімія
- •Тема 5. Фізико-хімія поверхневих та сорбційних явищ
- •Тема 6. Дисперсні системи. Класифікація, методи одержання та очищення.
- •Тема 7. Молекулярно-кінетичні, оптичні та електричні властивості дисперсних систем
- •Тема 8. Стійкість та коагуляція дисперсних систем.
- •Тема 9. Фізико-хімія вмр.
- •Тема 1 «Хімічна термодінамика».
- •Тема 2 «Хімічна кінетика та рівновага. Каталіз»
- •Тема 3 «Розчини»
- •Тема 4 «Електрохімія»
- •Колоїдна хімія
- •Тема 5 «Фізико-хімія поверхневих та сорбційних явищ».
- •Тема 6 «Загальна характеристика дисперсних систем. Класифікація, отримання та очищення дисперсних систем».
- •Тема 7 – 8 «Молекулярно-кінетичні, оптичні та електричні властивості дисперсних систем», «Стійкість та коагуляція дисперсних систем»
- •Тема 9 «Фізико-хімія вмр».
Колоїдна хімія
Тема 5 «Фізико-хімія поверхневих та сорбційних явищ».
Завдання 1.
Розрахуйте питому адсорбцію оцтової кислоти на вугіллі (в г/г вугілля), якщо 25,00 см30,198 М розчину оцтової кислоти збовтували із3 г вугілля і після встановлення адсорбційної рівноваги на його титрування пішло 11,00 см30,050 М розчину NaOH.
Розв’язання
Рівноважна концентрація кислоти в розчині після адсорбції дорівнює

Оскільки початкова кількість кислоти у розчині складала С0·V ммоль, а рівноважна кількість Ср·V ммоль, то різниця між цими величинами адсорбувалася на поверхні сорбенту масою m:

Тема 6 «Загальна характеристика дисперсних систем. Класифікація, отримання та очищення дисперсних систем».
Завдання 1.
Визначте питому поверхню порошку тетрацикліну (в м2/кг), якщо частинки його осідають в водному середовищі на відстані 0,235 м за 1500 с (частинки мають сферичну форму). Густина тетрацикліну – 1,57 г/см3; води – 1 г/см3; вязкість води 1·10-3 Па·с.
Розв’язання
Швидкість ламінарного руху сферичної частинки, яка вільно осідає під дією сили тяжіння:

де g – прискорення сили тяжіння, p і p0 – густина частинок дисперсної фази та дисперсійного середовища відповідно; r – радіус частинок; η – в’язкість дисперсійного середовища.
Визначаємо радіус частинок за рівнянням:

де υ – швидкість руху частинок, яку знаходять зі співвідношення шляху h до часу t, за який цей шлях було пройдено.

Питому поверхню знаходять як співвідношення поверхні частинки до її об’єму або маси:
 або
або

Питома поверхня дисперсної системи зі сферичним частинками може бути розрахована за рівнянням

де r – радіус частинки; р – густина дисперсної фази.
Знаходимо питому поверхню

Тема 7 – 8 «Молекулярно-кінетичні, оптичні та електричні властивості дисперсних систем», «Стійкість та коагуляція дисперсних систем»
Завдання 1.
Визначте до якого електроду повинні рухатись частинки золю йодиду срібла, який отримають за реакцією та певним надлишком KI

та який розчин – сульфату калію чи ацетату кальцію виявляє на нього більш сильну коагулюючу дію.
Розв’язання
Формула міцели золю йодиду срібла, стабілізованого надлишком KI, може бути записана в такому вигляді

У зв’язку з надлишком у розчині KI, іони I– (за рахунок вибіркової адсорбції на поверхні кристалів AgI) утворюють потенціалвизначаючий шар і частинка має негативний заряд. Отже, електрофоретичний рух буде направлений до аноду.
Іонами, що утворили дифузний шар, тобто протиіонами, є катіони К+. Отже, порівнювати коагулюючу дію, необхідно порівнювати заряди катіонів електроліту, що вводяться. Заряд Са2+ вищий ніж заряд іона К+, отже, в відповідності з правилом Шульце-Гарді, коагулююча дія Са(СН3СОО)2 є більш сильною.
Тема 9 «Фізико-хімія вмр».
Завдання 1.
Осмотичний тиск водяного розчину з масовою часткою гемоглобіну ω = 5% при 10 0С дорівнює 7315 Н/м2. Визначте молекулярну масу гемоглобіну (густина розчину – 1 г/мл).
Розв’язання
Молярну масу гемоглобіну розраховуємо за рівнянням Вант-Гоффа
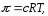
де с – молярна концентрація, моль/м3.


Mr =1.61·104.
6. ДОДАТКОВА ЛІТЕРАТУРА:
1. Гомонай В.І. Фізична та колоїдна хімія. – Вінниця, - Нова книга, 2007., 496 с.
2. Мороз С.А. Фізична та колоїдна хімія. – Л. – Світ, 1994, 280 с.
3. Мушкамбаров Н.Н. Физическая и коллоидная химия.- М.- МИА, 2008,303с.
