
- •Фізична та колоїдна хімія
- •Фізична хімія
- •Тема 1. Хімічна термодінамика
- •Тема 2. Хімічна кінетика та рівновага. Каталіз
- •Тема 3. Розчини
- •Тема 4. Електрохімія
- •Колоїдна хімія
- •Тема 5. Фізико-хімія поверхневих та сорбційних явищ
- •Тема 6. Дисперсні системи. Класифікація, методи одержання та очищення.
- •Тема 7. Молекулярно-кінетичні, оптичні та електричні властивості дисперсних систем
- •Тема 8. Стійкість та коагуляція дисперсних систем.
- •Тема 9. Фізико-хімія вмр.
- •Тема 1 «Хімічна термодінамика».
- •Тема 2 «Хімічна кінетика та рівновага. Каталіз»
- •Тема 3 «Розчини»
- •Тема 4 «Електрохімія»
- •Колоїдна хімія
- •Тема 5 «Фізико-хімія поверхневих та сорбційних явищ».
- •Тема 6 «Загальна характеристика дисперсних систем. Класифікація, отримання та очищення дисперсних систем».
- •Тема 7 – 8 «Молекулярно-кінетичні, оптичні та електричні властивості дисперсних систем», «Стійкість та коагуляція дисперсних систем»
- •Тема 9 «Фізико-хімія вмр».
Тема 3 «Розчини»
Завдання 1
Визначте осмотичний тиск 2 %-ного розчину глюкози при 0 0С. Густина розчину 1035 г/дм3.
Розв’язання
Осмотичний тиск визначають за законом Вант-Гоффа

де с – молярність розчину (моль/м3);
R
– газова стала (
 );
);
T – абсолютна температура (за умовою T = 273 K).
Знайдемо молярність розчину. Якщо розчин 2 %-ний, то в 100 г розчину міститься 2 г глюкози, тоді в 1035 грозчину (в 1 л) міститься х г глюкози. Маємо пропорцію

Звідки х = 20,7 г.
Знайдемо, якій кількості речовини відповідає ця маса:

М – молекулярна маса глюкози.
Таким чином, маємо розчин глюкози, в 1 л якого міститься 0,115 моля речовини. Тобто, концентрація розчину становить 0,115 моль/л = 115 моль/м3. Підставляючи відомі величин до виразу для обчислення осмотичного тиску, маємо

Розмірність

Тобто, осмотичний тиск 2 %-ного розчину глюкози становить 261018 Па.
Завдання 2
Опишіть механізм дії та виведіть рН гідрокарбонатного буферного розчину, якій підтримує стале значення рН (крові людини).
Розв’язання
Буферний розчин – це розчин, здатний підтримувати сталу концентрацію іонів водню (рН) при додаванні певної кількості сильної кислоти або лугу, при розведенні та концентрування.
Розглянемо, чому буферні розчини протидіють додаванню сильних кислот, лугів, розведенню та концентруванню.
Для системи Н2СО3/NaHCO3 можна записати


Якщо
до цієї системи додати сильну кислоту,
то іони Н+
будуть взаємодіяти з
 -іонами
солі, та утворювати слабодисоційовану
кислоту
-іонами
солі, та утворювати слабодисоційовану
кислоту .
.

Із рівняння випливає, що сильна кислота замінюється еквівалентною кількістю слабкої кислоти. Згідно з законом розведення Освальда, підвищення концентрації слабкого електроліту знижує ступінь її дисоціації, в наслідок чого концентрація іонів Н+ у розчині буде змінюватися незначно, тобто рН суттєво не змінюється.
При додаванні до буферного розчину лугу:

Луг
реагує з Н2СО3
та замінюється еквівалентною кількістю
солі, іони
 зменшують дисоціаціюН2СО3,яка
залишилася в розчині після добавлення
невеликої кількістьNaOH.
зменшують дисоціаціюН2СО3,яка
залишилася в розчині після добавлення
невеликої кількістьNaOH.
Розрахунок рН.

Запишемо вираз для константи дисоціації Н2СО3
 .
.
Із рівняння знайдемо рівноважну концентрацію іонів водню:
 .
.
Прологарифмуємо та помножимо на (-1) обидві частини рівняння, маємо
 .
.
 –водневий
показник.
–водневий
показник.
 –кислотний
показник.
–кислотний
показник.
Отримуємо формулу для розрахунку
 .
.
В зв’язку з тим, що рН буферного розчину залежить від співвідношення концентрацій солі та кислоти, то і при розбавленні, і при концентруванні цього розчину рН змінюватися не буде.
Тема 4 «Електрохімія»
Завдання 1.
Визначте напрям хімічної реакції
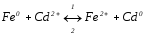 ,
,
використовуючи значення стандартних електродних потенціалівполуелементів:
 ,
,

Розв’язання
Складемо гальванічний елемент для даної реакції. Відбувається окиснення атомів заліза

та відновлення іонів кадмію

В гальванічному елементі негативним буде залізний електрод, а позитивним – кадмієвий. Схема гальванічного елемента:

За значеннями стандартних електродних потенціалів розраховуємо ЕРС цього гальванічного елемента:
 .
.
В зворотньому гальванічному елементі відбувається максимально корисна робота nFE, яка дорівнює зменшеннюенергії Гіббса:

де n – число електронів, які беруть участь в ОВР;
F – число Фарадея (9,65.104 Кл/моль);
Е – ЕРС гальванічного елемента.
Якщо початкові активності реагентів дорівнюють одиниці, то маємо

де Δ G0 – стандартна зміна енергія Гіббса,
Е0 – стандартна ЕРС.

В
зв’язку
з тим, що
 <0,
то реакція може перебігати в гальванічному
елементі в прямому напрямку самодовільно.
Максимальна робота при цьому дорівнює
зменшенню свобідної енергії Гіббса (
7720 кДж).
<0,
то реакція може перебігати в гальванічному
елементі в прямому напрямку самодовільно.
Максимальна робота при цьому дорівнює
зменшенню свобідної енергії Гіббса (
7720 кДж).
