
- •Фізична та колоїдна хімія
- •Фізична хімія
- •Тема 1. Хімічна термодінамика
- •Тема 2. Хімічна кінетика та рівновага. Каталіз
- •Тема 3. Розчини
- •Тема 4. Електрохімія
- •Колоїдна хімія
- •Тема 5. Фізико-хімія поверхневих та сорбційних явищ
- •Тема 6. Дисперсні системи. Класифікація, методи одержання та очищення.
- •Тема 7. Молекулярно-кінетичні, оптичні та електричні властивості дисперсних систем
- •Тема 8. Стійкість та коагуляція дисперсних систем.
- •Тема 9. Фізико-хімія вмр.
- •Тема 1 «Хімічна термодінамика».
- •Тема 2 «Хімічна кінетика та рівновага. Каталіз»
- •Тема 3 «Розчини»
- •Тема 4 «Електрохімія»
- •Колоїдна хімія
- •Тема 5 «Фізико-хімія поверхневих та сорбційних явищ».
- •Тема 6 «Загальна характеристика дисперсних систем. Класифікація, отримання та очищення дисперсних систем».
- •Тема 7 – 8 «Молекулярно-кінетичні, оптичні та електричні властивості дисперсних систем», «Стійкість та коагуляція дисперсних систем»
- •Тема 9 «Фізико-хімія вмр».
Тема 1 «Хімічна термодінамика».
С
С
Д
Е
А
Д
С
Е
С
В
Д
ТЕМА 2 «Хімічна кінетика та рівновага».
1. В
2. Е
3. Е
4. С
5. С
6. Д
7. А
8. Д
9. А
10.А
ТЕМА 3 «Розчини».
1. С
2.В
3.В
4.В
5.С
6. Д
7. С
8. Д
9. С
10. А
ТЕМА 4 «Електрохімія».
1.В
2.Д
3.С
4. А
5.В
6.Е
7.А
8.Д
9.A
ТЕМА 5 «Фізико-хімія поверхневих явищ».
1.А
2.Е
3.Д
4.С
5.А
6.А
7.С
ТЕМА 6 «Загальна характеристика дисперсних систем. Класифікація, отримання та очищення дисперсних систем».
1.А
2.Е
3.Д
4.А
5.В
6.А
7.Е
8.А
9.А
10.А
ТЕМА 7 «Молекулярно-кінетичні, оптичні та електричні властивості дисперсних систем».
1.Д
2.С
3.А
4.С
5.В
6.Д
7.А
8.А
ТЕМА 8 «Стійкість та коагуляція дисперсних систем».
1.Д
2.С
3.А
4.Д
5.Е
6.С
7.В
8.С
ТЕМА 9 «Фізико-хімія ВМР».
1.Е
2.С
3.А
4.В
5.В
6.Е
7.Д
5. ПРИКЛАД РОЗВ’ЯЗУВАННЯ СИТУАЦІЙНОГО ЗАВДАННЯ
Тема1 «Хімічна термодінамика»
Завдання 1.
Розрахуйте тепловий ефект реакції

при 600 К, якщо стандартні теплоти утворення газоподібного етанолу, етилену та води дорівнюють відповідно: -234,80; -52,30; -241,81 кДж/моль, а молярні теплоємності описуються рівняннями:

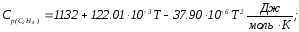
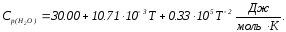
Розв’язання
Розраховуємо тепловий ефект реакції при стандартних умовах за наслідком із закона Гесса



Тепловий ефект при 600 К розраховуємо за рівнянням Кірхгофа


Враховуючи залежності



 .
.
Підставляємо
значення
 і
і та інтегруємо рівняння Кірхгофа, маємо
та інтегруємо рівняння Кірхгофа, маємо

Завдання 2.
Гексаметилентетрамін (уротропін) отримують за реакцією

За відповідними значеннями стандартними ентальпії утворення та ентропій
|
|
NH3(г) |
H2O |
CH2O |
(CH2)6N4 |
|
|
-45.94 |
-285.83 |
-115.90 |
-99.20 |
|
|
192.66 |
69.95 |
218.78 |
37.67 |
Розрахуйте зміну енергії Гіббса в результаті реакції і визначте напрям реакції.
Розв’язання
Зміну
ентальпії і ентропії
і ентропії при стандартних умовах можна розрахувати
за наслідком із закону Гесса
при стандартних умовах можна розрахувати
за наслідком із закону Гесса




 ,
,
 –
стандартна теплота і ентропія утворення
вихідних речовин та продуктів реакції.
–
стандартна теплота і ентропія утворення
вихідних речовин та продуктів реакції.

 .
.
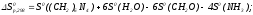

Зміну енергії Гіббса реакції можна розрахувати за рівнянням Гіббса-Гельмгольца


Враховуючи,
що
 <0,
то реакція протікає самодовільно в
прямому напрямку.
<0,
то реакція протікає самодовільно в
прямому напрямку.
Тема 2 «Хімічна кінетика та рівновага. Каталіз»
Завдання 1.
Вкажіть молекулярність і загальний порядок наступної реакції:
 .
.
Напишіть рівняння для константи рівноваги та визначить у якому напрямку буде зрушуватися рівновага з підвищенням температури та тиску.
Розв’язання
Молекулярність – це число молекул, які зустрічаються в елементарному акті хімічної взаємодії. Дана реакція бімолекулярна.
Порядок реакції – це сума показників степенів концентрацій (парціальних тисків)у виразі закону діючих мас. Для даної реакції маємо

Загальний порядок реакції 2+3=5.


За принципом Ле-Шательє: якщо на систему, яка знаходиться в рівновазі, застосувати зовнішній вплив (змінити Т, Р…), система буде противодіяти цьому і рівновага зміститься в сторону зменшення цього впливу.
В зв’язку з тим, що для прямої реакції ΔН < 0, то підвищення температури зміщує рівновагу в сторону реакції з поглинанням тепла (ендотермічної, в сторону вихідних речовин). Для розрахунку впливу тиску розрахуємо число молей газу до ( 5 молів газу) та після ( 3 моля газу) реакції. При підвищенні тиску рівновага зміщується в сторону менших кількостей речовини газу.
Завдання 2.
При дослідженні терміну зберігання пенталгіну було показано, що протягом 50 діб при температурі 75 0С з препаратом не відбулося суттєвих змін. Чи можна зберігати ці ліки протягом 3,5 років при 25 0С?
Розв’язання
За стандартним виразом для обчислення терміну зберігання ліків знайдемо скільки часу можна зберігати ліки при температурі 25 0С (298 К)

де γ – температурний коефіціент, прийнятий ДЕРЖ Фармакопією γ = 2.

n – кількість десятків градусів між температурами T2 = 75 0С і T1 = 25 0С (n = 5).
τТ– термін зберігання ліків при Т2 = 75 0С (за умовою τТ = 50 діб).
Підставляючи числові значення, маємо
 .
.
Оскільки, ліки можна зберігати при температурі Т1 = 25 0С протягом 4,4 років, то звичайно їх можна зберігати при цій температурі протягом 3,5 років.


