- •Ферменты
- •Ферменты
- •Строение ферментов
- •Апофермент и кофермент
- •Строение ферментов
- •Функциональные участки молекулы фермента
- •Функциональные участки молекулы фермента
- •Аллостерический (регуляторный) центр
- •Лизоцим
- •Дрожжевая гексокиназа
- •Backbones of chymotrypsinogen and alpha-chymotrypsin
- •The structures of chymotrypsin, trypsin, and elastase
- •Классификация ферментов
- •Классификация ферментов
- •Классификация ферментов
- •Класс
- •Классификация ферментов
- •Номенклатура ферментов
- •Шифр ферментов
- •Шифр
- •Механизм действия ферментов
- •Механизм действия ферментов
- •Механизм действия ферментов
- •Механизм действия ферментов
- •Механизм действия ферментов
- •Механизм действия ферментов
- •Коферменты
- •Роль кофактора и кофермента
- •Коферменты – производные витаминов
- •Коферменты – производные витаминов
- •ФАД. Витамин В2 (рибофлавин)
- •Витамин В6. Пиридоксальфосфат
- •Роль иона Ме:
- •Роль иона Ме
- •Некоторые металлозависимые ферменты
- •Специфичность ферментов
- •Специфичность ферментов
- •Специфичность ферментов
- •Зависимость скорости ферментативной реакции от времени
- •Зависимость скорости ферментативной
- •Зависимость скорости ферментативной реакции от температуры
- •Зависимость скорости ферментативной реакции от температуры
- •Зависимость V реакции от рН среды
- •Зависимость V реакции от рН среды
- •Влияние рН на активность Е
- •Оптимум рН папаина 6,2
- •Зависимость V реакции от [E]
- •Влияние концентрации S на V
- •Влияние концентрации S на V
- •Vmax и Кm
- •Уравнение Михаэлиса-Ментен
- •Леонор Mихаэлис (1875-1949) и Мауд Meнтен (1879-1960) пионеры в кинетике ферментов.
- •Влияние [S] на V у аллостерических ферментов
- •Влияние [S] на V у аллостерических ферментов
- •Кривые насыщения Нв и Мв О2
- •Уравнение и график Лайнуивера-Бэрка
- •Особенности конкурентного ингибирования:
- •Ингибиторы
- •Пример конкурентного ингибирования
- •Неконкурентное ингибирование
- •Бесконкурентное и смешанное ингибирование
- •Влияние конкурентного, неконкурентного и бесконкурентного ингибиторов на кинетику ферментативной реакции
- •Значение изучения и использования в медицине ингибиторов
- •Мультимолекулярные (мультиэнзимные) ферментные системы
- •Субклеточная локализация ферментов
- •Субклеточная локализация ферментов
- •Органоспецифические ферменты
- •Изоферменты
- •ЛАКТАТДЕГИДРОГЕНАЗА
- •Лактатдегидрогеназа
- •Креатинкиназа
- •Определение активности ферментов
- •Единицы активности ферментов
- •Единицы активности ферментов
- •Проблемы медицинской энзимологии
- •Энзимодиагностика
- •Диагностика заболеваний по активности Е в биологических жидкостях
- •Диагностика заболеваний по активности Е в биологических жидкостях
- •Ферменты крови Энзимодиагностика
- •Диагностическое значение ферментов
- •Диагностическое значение ферментов
- •Диагностическое значение ферментов
- •Использование ферментов как аналитических реагентов в
- •Энзимотерапия
- •Ферменты как лекарственные препараты
- •Ферменты как лекарственные препараты
- •Иммобилизованные ферменты
- •Регуляция активности ферментов
- •Частичный (ограниченный) протеолиз
- •Частичный (ограниченный) протеолиз
- •Частичный (ограниченный) протеолиз
- •Частичный (ограниченный) протеолиз
- •Частичный (ограниченный)
- •Частичный протеолиз
- •Посттрансляционная модификация инсулина
- •Частичный протеолиз препроинсулина
- •Частичный (ограниченный) протеолиз
- •Аллостерическая регуляция
- •Аллостерическая регуляция
- •Аллостерическая регуляция ферментов
- •Аллостерическая регуляция
- •Ингибирование по принципу обратной связи (ретроингибирование)
- •Аллостерческая регуляция
- •Исходные вещества как активаторы ключевых Е
- •Аллостерическая регуляция гликолиза
- •Схема гликолиза
- •Ковалентная модификация ферментов путем
- •Ковалентная модификация ферментов путем фосфорилирования-дефосфорилирования
- •Ковалентная модификация ферментов путем фосфорилирования-дефосфорнилирования
- •Ковалентная модификация ферментов. Серин-треонин и
- •Строение рецептора инсулина, содержащего
- •Ковалентная модификация ферментов путем фосфорилирования-дефосфорнилирования
- •Ковалентная модификация Е
- •Регуляция с помощью белок- белковых взаимодействий
- •Активация врезультате присоединения регуляторных белков
- •Рецепторы, действующие через G- белки
- •Структура мембранного рецептора
- •Активация Е в результате присоединения регуляторных белков на примере АЦ.
- •Характеристика G -белков
- •Типы G-белков
- •Регуляция активности ферментов путем ассоциации или диссоциации на примере протеинкиназы А
- •Образование цАМФ из АТФ
- •Регуляция активности ферментов путем
- •Регуляция активности ферментов путем ассоциации или диссоциации на примере протеинкиназы А
- •Синтез цАМФ из АТФ
- •Распад цАМФ под действием фосфодиэстеразы
- •Схема аденилатциклазной системы регуляции
- •Аденилатциклазный механизм распада гликогена
- •Регуляция распада гликогена гормонами
- •Образование цГМФ из ГТФ
- •2 формы гуанилатциклазы
- •Гуанилатциклазный механизм регуляции активности Е
- •Гуанилатциклаза
- •Инозитолфосфатный цикл
- •Инозитолфосфатный цикл
- •Схема инозитолфосфатной системы регуляции.
- •Структура
- •Строение кальмодулина
- •Контроль транскрипции
- •Другие типы регуляции активности
- •Другие типы регуляции активности
- •Строение рецептора инсулина, содержащего тирозинкиназные домены

Ферменты 
И.С. Григ

Ферменты
 Ферменты (энзимы, Е) – биокатализаторы белковой природы. Наука – энзимология.
Ферменты (энзимы, Е) – биокатализаторы белковой природы. Наука – энзимология.
 Биороль –каталитическая и регуляторная
Биороль –каталитическая и регуляторная
 Особенности ферментативного катализа:
Особенности ферментативного катализа:
-высокая эффективность действия
-специфичность
- способность к регуляции
- мягкие условия протекания ферментативных реакций (t = 37º С, нормальное атмосферное давление, рН близкое к 7,0).
реакций (t = 37º С, нормальное атмосферное давление, рН близкое к 7,0). 

Строение ферментов
 Субстрат (S) – лиганд, взаимодействующий с активным центром фермента.
Субстрат (S) – лиганд, взаимодействующий с активным центром фермента.
 Продукт реакции (Р).
Продукт реакции (Р).
 Ферментативная реакция в общем виде:
Ферментативная реакция в общем виде:
Е
S P

Апофермент и кофермент
 В составе фермента, являющегося
В составе фермента, являющегося  сложным белком – апофермент (белковая часть) и небелковая часть (низкомолекулярные органические соединения – коферменты или ионы металлов – кофакторы). Комплекс
сложным белком – апофермент (белковая часть) и небелковая часть (низкомолекулярные органические соединения – коферменты или ионы металлов – кофакторы). Комплекс  апофермента и кофермента –
апофермента и кофермента –  холофемент.
холофемент. 
 Апофермент + кофермент ↔ холофермент
Апофермент + кофермент ↔ холофермент

Строение ферментов
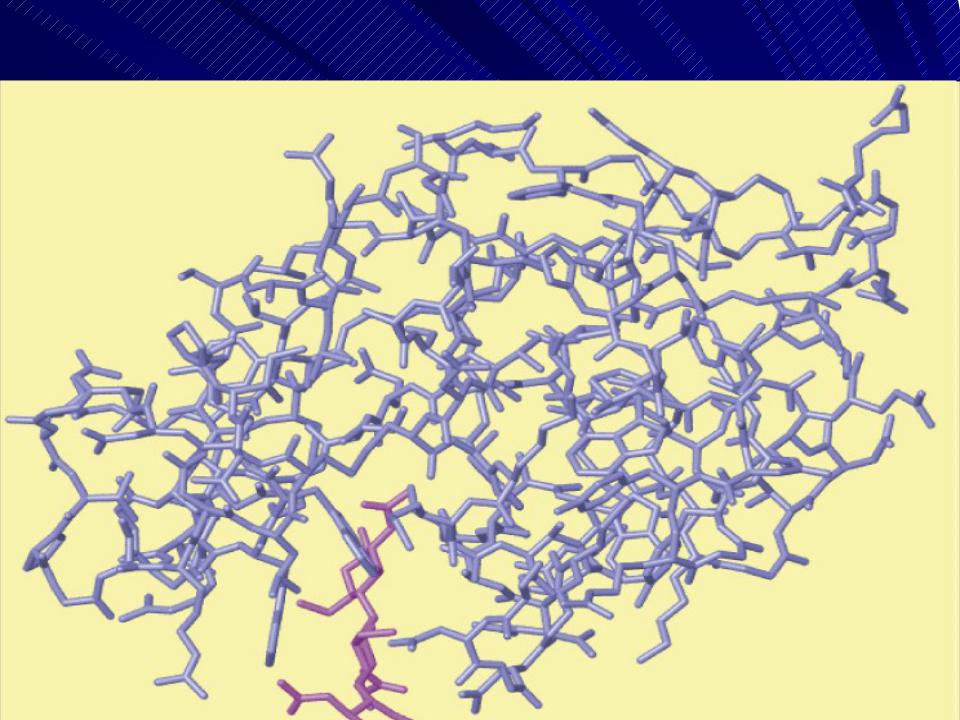
 Активный центр (АкЦ) – уникальная комбинация АК остатков в молекуле фермента, обеспечивает связывание её с молекулой S и участие в акте катализа, расположен в узком гидрофобном углублении (щели) молекулы фермента, образуется на уровне третичной структуры
Активный центр (АкЦ) – уникальная комбинация АК остатков в молекуле фермента, обеспечивает связывание её с молекулой S и участие в акте катализа, расположен в узком гидрофобном углублении (щели) молекулы фермента, образуется на уровне третичной структуры

Функциональные участки молекулы фермента
 В АкЦ Е различают:
В АкЦ Е различают:
 участок связывания (обеспечивает субстратную специфичность — выбор S) и
участок связывания (обеспечивает субстратную специфичность — выбор S) и
 каталитический участок (обеспечивает выбор пути химического превращения субстрата).
каталитический участок (обеспечивает выбор пути химического превращения субстрата).
 S связывающий участок по форме
S связывающий участок по форме
соответствует S (геометрическое  соответствие), между АК остатками
соответствие), между АК остатками  активного центра и S образуются связи (Н, гидрофобные, ионные), т.е. устанавливается электронное или
активного центра и S образуются связи (Н, гидрофобные, ионные), т.е. устанавливается электронное или  химическое соответствие.
химическое соответствие. 

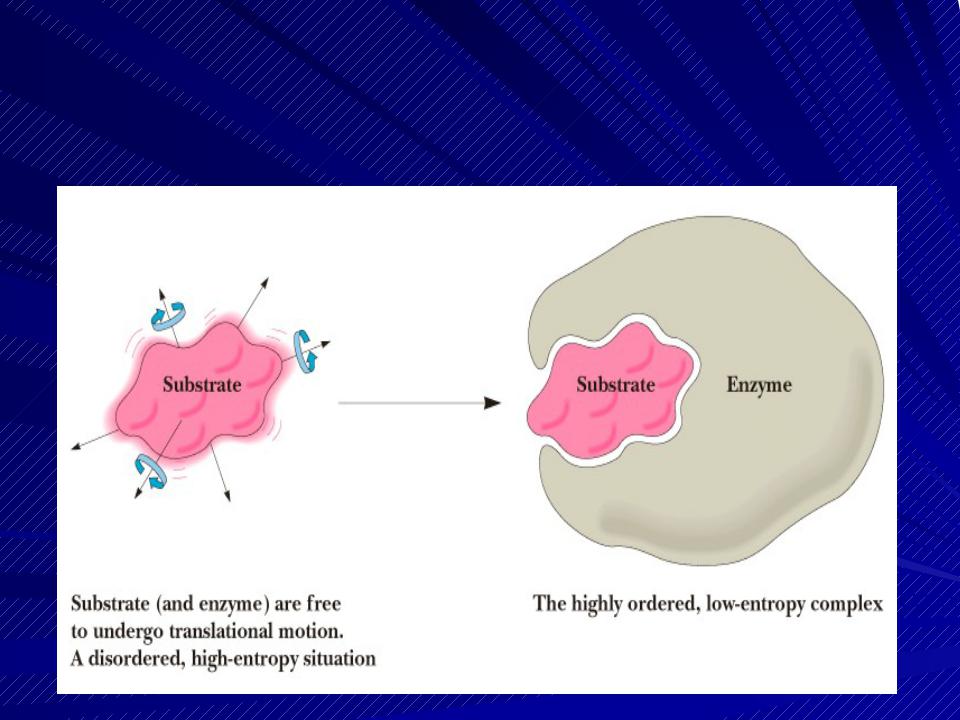
Функциональные участки молекулы фермента
 S комплементарен активному центру (гипотеза «ключ-замок», теория индуцированного соответствия).
S комплементарен активному центру (гипотеза «ключ-замок», теория индуцированного соответствия).
 аллостерический центр (регуляторный) центр – участок молекулы фермента, с которым связываются низкомолекулярные вещества (эффекторы, или модификаторы), изменяющие активность Е. Такой Е — аллостерический.
аллостерический центр (регуляторный) центр – участок молекулы фермента, с которым связываются низкомолекулярные вещества (эффекторы, или модификаторы), изменяющие активность Е. Такой Е — аллостерический.
 В АкЦ фермента - участок или домен для связывания кофермента;
В АкЦ фермента - участок или домен для связывания кофермента; 
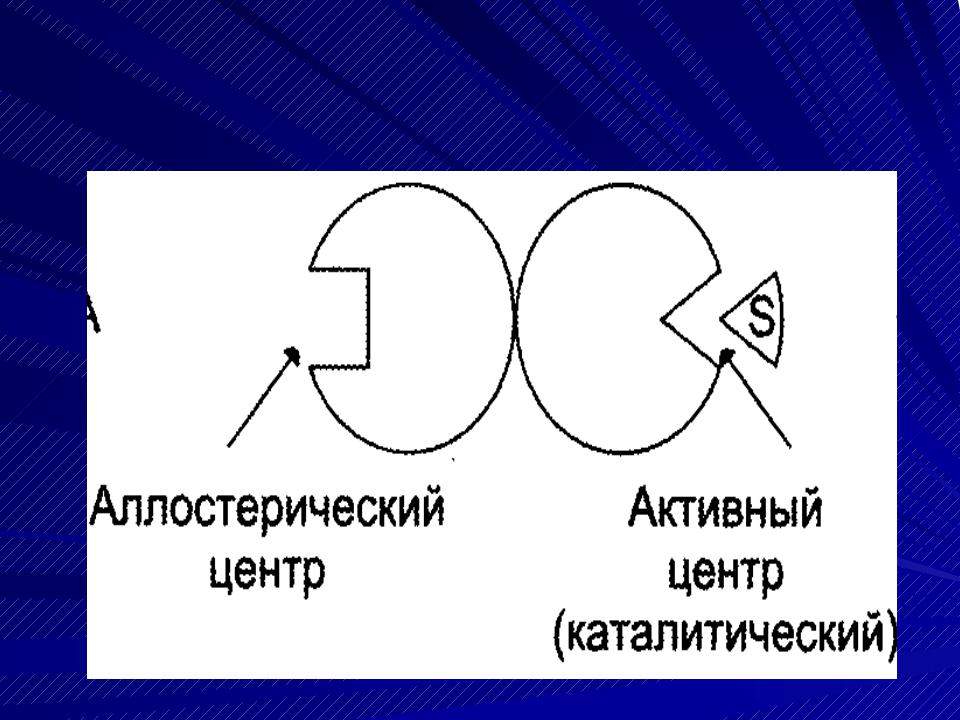
Аллостерический (регуляторный) центр