
- •Глава 1. Введение в титриметрические методы анализа. Вопросы к занятию:
- •§1. Правила техники безопасности.
- •§2. Понятие о химическом эквиваленте и факторе эквивалентности.
- •Основность кислоты
- •§3. Способы выражения концентрации растворов.
- •§4. Задачи для самостоятельного решения.
- •Глава II. Кислотно-основное титрование. Вопросы к занятию:
- •§1. Введение.
- •§2. Теоретические основы титриметрического метода анализа.
- •§3. Кислотно-основное титрование.
- •§4. Кривые титрования. Выбор индикатора.
- •§5. Вопросы и задачи для самостоятельного решения.
- •§6. Лабораторный практикум.
- •Ход работы.
- •Лабораторная работа № 2 Кислотно – основное титрование
- •§7. Учебно-исследовательская работа студентов (уирс).
- •Глава III. Оксидиметрия Вопросы к занятию:
- •§1. Теоретические основы методов оксидиметрии. Окислительно-восстановительные методы объемного анализа основаны на применении окислительно-восстановительных реакций.
- •§2. Типы окислительно-восстановительных реакций.
- •§3. Перманганатометрия.
- •Приготовление рабочего раствора kMnO4
- •§4. Иодометрия.
- •§5. Лабораторный практикум. Работа 1. Установление нормальности и титра kMnO4 по 0,05н раствору щавелевой кислоты.
- •Работа 2 Установление нормальности и титра раствора тиосульфата натрия по бихромату калия.
- •§6. Задачи для самостоятельного решения.
- •Глава IV. Химическая термодинамика
- •Вопросы к занятию
- •§1. Основные понятия термодинамики.
- •§2. Первый закон термодинамики. Энтальпия.
- •§3. Закон Гесса.
- •§4. Следствия из закона Гесса.
- •Причем следует учесть, что ∆н° образования простых веществ равна нулю.
- •§5. Второй закон термодинамики. Энтропия.
- •Знак неравенства относится к необратимым процессам, а знак равенства - к обратимым процессам.
- •§6. Энергия Гиббса и направление химических реакций.
- •§7. Химическое равновесие.
- •§8. Основы биоэнергетики.
- •§9. Лабораторный практикум.
- •§10. Примеры решения задач.
- •§11. Задачи для самостоятельного решения.
Работа 2 Установление нормальности и титра раствора тиосульфата натрия по бихромату калия.
К определенному количеству титрованного раствора K2Cr2O7приливают КIв кислой среде. Выделившийся йод оттитровывают раствором тиосульфата натрия. Реакции протекают по уравнению:
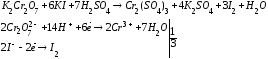
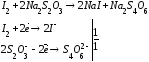
Ход определения
Приступая к титрованию, наполняют бюретки раствором Na2S2O3 и устанавливают уровень жидкости в ней на 0. В колбу для титрования мерным цилиндром или градуированной пробиркой вносят 1-2 мл 5%-ного раствора КIи 2-3 мл 1н раствора H2SO4. Затем к полученной смеси пипеткой Мора добавляют 5 мл 0,02н раствора K2Cr2O7(кончик пипетки при этом не должен касаться смеси). Полученную смесь слегка перемешивают, колбу закрывают часовым или предметным стеклом, чтобы предупредить потери от улетучивания йода и оставляют для завершения реакции на 5 минут. Выделившийся йод титруют тиосульфатом натрия (Na2S2O3) до светло-желтой окраски, затем прибавляют 4-5 капель крахмала и продолжают титровать до перехода синей окраски в бледно-зеленую (или бесцветную) от одной капли раствора тиосульфата натрия. Последние капли прибавляют медленно, хорошо перемешивая раствор. Титрование повторяют 2-3 раза. Из полученных результатов (разность не более 0,1 мл) берут среднее значение для расчетов. Данные заносят в таблицу.
Таблица 8.
|
№ оп. |
V(K2Cr2O7) |
N(K2Cr2O7) |
V(Na2S2O3) |
N(Na2S2O3) |
T(Na2S2O3) |
|
1 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
среднее |
|
|
|
|
|
§6. Задачи для самостоятельного решения.
Укажите, какие из приведенных процессов представляют собой окисление и какие – восстановление:
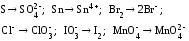
Расставьте коэффициенты в уравнениях следующих реакций:
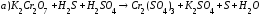
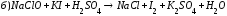
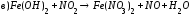
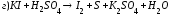
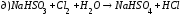
Закончите уравнения реакций и расставьте коэффициенты:

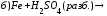
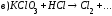
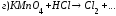
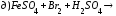
4.Рассчитайте навеску KMnO4, необходимую для приготовления 1 л 0,02н раствора
5.На титрование 4,5 мл 0,1н раствора щавелевой кислоты израсходовано 55 мл KMnO4. Рассчитайте нормальность и титр раствораKMnO4.
Глава IV. Химическая термодинамика
«Каким бы ни было исследуемое вещество,
термохимия открывает новые возможности
для наших исследований. Она по своей природе
является для химии тем же, чем микроскоп для
натуралиста, подзорная труба для астронома».
Г.И.Гесс
