
- •Вопрос 104
- •Классификация
- •Биполярные ионы аминокислот
- •Образование хелатных комплексов
- •Вопрос 105
- •Синтез петидов.
- •Синтез пептидов
- •Вопрос 106
- •Свойства
- •Применение
- •Свойства
- •Химические[править | править вики-текст]
- •Физические
- •Медицинские
- •Общие сведения[править | править вики-текст]
- •Вопрос 107 Классификация углеводов
- •Икло-оксо-таутомерия моносахаридов
- •Вопрос 108
- •Химические свойства[править | править вики-текст]
- •Окисление моносахаридов
- •Вопрос 109
- •Номенклатура олигосахаридов
- •Вопрос 110
- •Крахмал[править | править вики-текст]
- •Гликоген[править | править вики-текст]
- •Целлюлоза[править | править вики-текст]
- •Вопрос 111
Вопрос 105
Пептиды (греч. πεπτος — питательный) — семейство веществ, молекулы которых построены из двух и более остатковаминокислот, соединённых в цепь пептидными (амидными) связями —C(O)NH—. Обычно подразумеваются пептиды, состоящие из α-аминокислот, однако термин не исключает пептидов, полученных из любых других аминокарбоновых кислот.[1]
Пептиды, последовательность которых короче примерно 10-20 аминокислотных остатков могут также называться олигопептидами, при большей длине последовательности они называются полипептидами. Белками обычно называют полипептиды, содержащие примерно от 50 аминокислотных остатков.[2]
В 1900 году немецкий химик-органик Герман Эмиль Фишер выдвинул гипотезу о том, что пептиды состоят из цепочки аминокислот, образованных определёнными связями. И уже в 1902 году он получил неопровержимые доказательства существования пептидной связи, а к 1905 году разработал общий метод, при помощи которого стало возможным синтезировать пептиды в лабораторных условиях.
Постепенно учёные изучали строение различных соединений, разрабатывали методы разделения полимерных молекул на мономеры, синтезировали все больше и больше пептидов.
Полипептиды могут иметь в молекуле неаминокислотные фрагменты, например углеводные остатки.
Природные и синтетические полипептиды с молекулярной массой более 5000[3](6000[4])-10000[5][6] дальтон называют белками.
Белки́ (протеи́ны, полипепти́ды[1]) — высокомолекулярные органические вещества, состоящие из альфа-аминокислот, соединённых в цепочку пептидной связью. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций создают молекулы белков с большим разнообразием свойств. Кроме того, аминокислотные остатки в составе белка часто подвергаютсяпосттрансляционным модификациям, которые могут возникать и до того, как белок начинает выполнять свою функцию, и во время его «работы» в клетке. Часто в живых организмах несколько молекул разных белков образуют сложные комплексы, например, фотосинтетический комплекс.
Кристаллы различных белков, выращенные на космической станции «Мир» и во время полётовшаттлов НАСА. Высокоочищенные белки при низкой температуре образуют кристаллы, которые используют для изученияпространственной структурыданного белка
Функции белков в клетках живых организмов более разнообразны, чем функции других биополимеров — полисахаридов и ДНК. Так, белки-ферменты катализируют протекание биохимических реакций и играют важную роль в обмене веществ. Некоторые белки выполняют структурную или механическую функцию, образуя цитоскелет, поддерживающий форму клеток. Также белки играют ключевую роль в сигнальных системах клеток, при иммунном ответе и в клеточном цикле.
Белки — важная часть питания животных и человека (основные источники: мясо, птица, рыба, молоко, орехи, бобовые, зерновые; в меньшей степени: овощи, фрукты, ягоды и грибы), поскольку в их организмах не могут синтезироваться все необходимые аминокислоты и часть должна поступать с белковой пищей. В процессе пищеварения ферменты разрушают потреблённые белки до аминокислот, которые используются для биосинтеза собственных белков организма или подвергаются дальнейшему распаду для получения энергии.
Определение аминокислотной последовательности первого белка — инсулина — методом секвенирования белков принеслоФредерику Сенгеру Нобелевскую премию по химии в 1958 году. Первые трёхмерные структуры белков гемоглобина и миоглобинабыли получены методом дифракции рентгеновских лучей, соответственно, Максом Перуцем и Джоном Кендрю в конце 1950-х годов[2][3], за что в 1962 году они получили Нобелевскую премию по химии.
Строение пептида
Количество аминокислот в составе пептидов может сильно варьировать. Пептиды, содержащие до 10 аминокислот, называют олигопептиды Часто в названии таких молекул указывают количество входящих в состав олигопептида аминокислот: трипептид, пентапептид, окгапептид и т.д.
Пептиды, содержащие более 10 аминокислот, называют "полипептиды", а полипептиды, состоящие из более чем 50 аминокислотных остатков, обычно называют белками. Однако эти названия условны, так как в литературе термин "белок" часто употребляют для обозначения полипептида, содержащего менее 50 аминокислотных остатков. Например, гормон глюкагон, состоящий из 29 аминокислот, называют белковым гормоном.
Мономеры аминокислот, входящих в состав белков, называют "аминокислотные остатки". Аминокислотный остаток, имеющий свободную аминогруппу, называется N-концевым и пишется слева, а имеющий свободную ?-карбоксильную группу - С-концевым и пишется справа. Пептиды пишутся и читаются с N-конца. Цепь повторяющихся атомов в полипептидной цепи -NH-CH-CO-носит название "пептидный остов" (см. схему Б).
При названии полипептида к сокращённому названию аминокислотных остатков добавляют суффикс -ил, за исключением С-концевой аминокислоты. Например, тетрапептид Сер-Гли-Про-Ала читается как серилглицилпролилаланин.
Пептидная связь, образуемая иминогруппой пролина, отличается от других пептидных связей, так как атом азота пептидной группы связан не с водородом, а с радикалом.
Пептиды различаются по аминокислотному составу, количеству и порядку соединения аминокислот.

Серилглицилпролилаланин

Схема А. Образование дипептида


Схема Б. Строение пептидов

Сер-Гис-Про-Ала и Ала-Про-Гис-Сер - два разных пептида, несмотря на то, что они имеют одинаковые количественный и качественный составы аминокислот.
Первичная структура пептидов и белков определяется путем последовательного отщепления α-аминокислот с какого-либо конца макромолекулярной цепи и их идентификации.
В настоящее время разработано много методов определения аминокислотной последовательности. Остановимся на некоторых из них :
1) Метод Сенгера - один из первых методов с 2,4-динитрофторбензолом (ДНФБ)
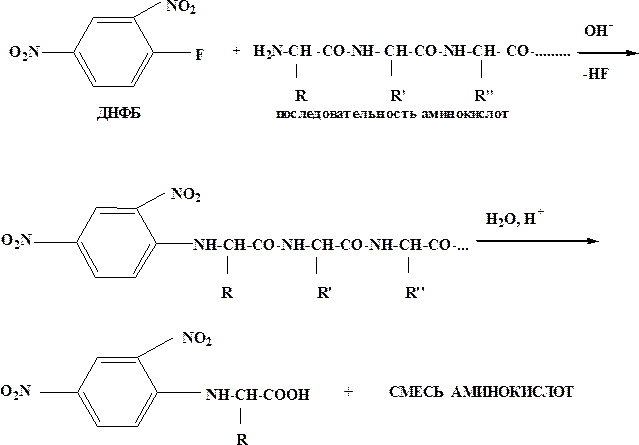
2) Метод Эдмана с фенилизотиоцианатом (ФТГ)
Преимуществом этого метода является то, что при отщеплении каждой N-концевой α-аминокислоты, остальная часть пептидной молекулы не разрушается. Такие же операции можно повторять дальше до полного определения первичной структуры и этот метод получил название деградации по Эдману (1950 год)

Метод Эдмана лежит в основе автоматического прибора - секвенатора (sequence от английского - последовательность). Полученное на каждой стадии производное идентифицируется либо ГЖХ либо ТСХ или жидкостной хроматографией.
Частичный гидролиз полипептидов.
При частичном гидролизе пептиды расщепляются с образованием более коротких цепей. Частичный гидролиз проводят с помощью ферментов, которые гидролизуют пептидные связи избирательно, например, только с N-конца (аминопептидазы) или только с С-конца (карбоксипептидазы).
![]()
Существуют ферменты, расщепляющие пептидные связи только между определенными аминокислотами. Меняя условия гидролиза, можно разбить пептид на различные фрагменты, которые перекрываются по составляющим их аминокислотным остаткам. Анализ продуктов частичного гидролиза позволяет воссоздать структуру исходного пептида. Рассмотрим простейший пример установления структуры трипептида. Частичный гидролиз по двум разным направлениям трипептида неизвестного строения дает продукты представленные на схеме.

Единственный трипептид, структура которого не противоречит продуктам частичного гидролиза – Gly-Ala-Phe.
Установление аминокислотной последовательности пептидов, содержащих несколько десятков аминокислотных остатков, – более сложная задача, которая требует комбинации различных методов.
