
- •Предисловие
- •Введение
- •Роберт Вильгельм Бунзен
- •Анри Луи Ле Шаталье
- •Вильгельм Фридрих Оствальд
- •Сванте Август Аррениус
- •Якоб Генрих Вант-Гофф
- •Иоханн Николаус Брёнстед и Михаил Ильич Усанович
- •Николай Николаевич Семенов
- •Химическая термодинамика учебно-целевые задачи – научить студентов:
- •Значимость темы
- •Основные понятия и определения химической термодинамики
- •Внутренняя энергия
- •Теплота и работа
- •Первый закон термодинамики
- •Применение I закона к простейшим процессам
- •Тепловые эффекты. Закон гесса
- •Теплоемкость
- •Второй закон термодинамики
- •Некоторые формулировки 2-го закона
- •Изменение энтропии при различных процессах
- •Пастулат планка
- •Термодинамические потенциалы
- •Соотношение между термодинамическими потенциалами
- •Закон действующих масс
- •Вопросы по теме: "термодинамика"
- •Примеры решения типовых задач
- •Пример решения контрольного задания по теме "Термодинамика"
- •Решение
- •Задачи для самостоятельной работы
- •Варианты заданий для домашней контрольной работы
- •Лабораторная работа №1.
- •Особые условия выполнения работы:
- •Устройство и настройка термометра Бекмана
- •Термодинамика фазовых превращений
- •Термодинамика фазовых равновесий
- •Основные понятия
- •Уравнение клайперона-клаузиуса
- •Диаграммы состояния однокомпонентных систем
- •Диаграмма состояния воды
- •Диаграмма состояния диоксида углерода
- •Бинарные системы Диаграммы плавкости
- •Взаимная растворимость жидкостей
- •Трехкомпонентные системы
- •Равновесие жидкость-жидкость в трехкомпонентных системах.
- •Распределение растворяемого вещества между двумя жидкими фазами. Экстракция.
- •Вопросы для подготовки к занятиям по теме: "термодинамика фазовых равновесий".
- •Примеры решения типовых задач.
- •Задачи для самостоятельной работы.
- •Лабораторная работа 1: построение диаграммы плавкости 2-х компонентной системы с простой эвтектикой.
- •Лабораторная работа № 2. Изучение взаимной растворимости фенола и воды.
- •Лабораторная работа № 3. Определение коэффициента распределения уксусной кислоты между водой и бензолом.
- •Свойства разбавленных растворов электролитов и неэлектролитов.
- •Повышение температуры кипения растворов.
- •Понижение температуру замерзания растворов.
- •Биологическое значение осмотического давления
- •Указания к выполнению работы.
- •Вопросы для самоконтроля по технике выполнения работы
- •Вопросы для самоконтроля при выполнении данного задания
- •Вопросы и задачи для самоконтроля усвоения темы
- •Вопросы для самоконтроля усвоения материала практической работы
- •Биологический статус изучаемой темы
- •Вопросы для подготовки:
- •Диссоциация воды
- •Водородный показатель
- •Механизм действия буферных систем
- •РН буферных систем
- •Влияние изменения объема буферных систем на рН.
- •Кислотно-щелочное равновесие крови
- •Роль внутренних органов в поддержании кислотно-щелочного резерва.
- •Изменение кислотно-щелочного равновесия при различных заболеваниях.
- •Задачи и задания для самостоятельной работы
- •Экспериментальная часть
- •Работа №3. Определение буферной ёмкости.
- •Электрохимия. Учебно-целевые задачи: Изучив этот раздел учебной программы, студент должен знать:
- •Значение электрохимических явлений для медицины.
- •Электродные процессы и электродвижущие силы.
- •Электрод и электродный потенциал.
- •Строение двойного электрического слоя на границе раствор-металл
- •Уравнение нернста
- •Гальванические элементы и их электродвижущие силы
- •Концентрационные гальванические элементы.
- •Диффузный потенциал.
- •Электроды первого рода.
- •Водородный электрод.
- •Ионоселективные электроды
- •Стеклянный электрод
- •Электроды второго рода.
- •Хлорсеребряный электрод Аg ׀ Ag Cl. KCl
- •Сопровождается реакцией растворения или осаждения соли АgСl:
- •Окислительно – восстановительные системы (ов) и ов –электроды.
- •Уравнение Петерса.
- •Классификация обратимых электродов.
- •Измерение эдс гальванических элементов.
- •Потенциометрия.
- •Прямые потенциометрические методы.
- •Приложение
- •Экспериментальная часть. Лабораторная работа №1. Измерение эдс гальванических элементов.
- •Порядок выполнения работы.
- •Изменение потенциалов отдельных электродов.
- •Потенциалов отдельных электродов.
- •Лабораторная работа № 3.
- •Лабораторная работа №4. Потенциометрическое измерение окислительно – восстановительных потенциалов. Редокс – системы.
- •Кинетика
- •Значение для медицины и фармации
- •Вопросы для подготовки к занятию
- •Введение
- •Понятие о скорости химического процесса
- •Основной закон химической кинетики
- •Кинетические уравнения реакций
- •Реакции первого порядка
- •Реакции второго порядка
- •Сложные реакции
- •Гетерогенные реакции
- •Температурная зависимость константы скорости реакции.
- •Методы расчета энергии активации и предэкспоненциального множителя а.
- •Основы молекулярной кинетики
- •Теория активных столкновений
- •Теория переходного состояния
- •Задачи и задания для самостоятельного решения.
- •Экспериментальная часть
- •Опыт № 1.Зависимость от концентрации.
- •Опыт №2. Зависимость от температуры
- •Учебно-методическое и информационное обеспечение дисциплины
- •По технике безопасности
- •И производственной санитарии при работе
- •В химических лабораториях
- •Медицинских учебных заведений
- •Содержание
Гетерогенные реакции
Они протекают в системе, состоящей из нескольких фаз(Г-Т;Г-Ж;Ж-Т)
В этом случае реакция протекает на поверхности двух фаз. Как правило, любая гетерогенная реакция состоит по меньшей мере из трех стадий:
1. Перенос реагирующих веществ к поверхности раздела фаз.
2. Собственно химическая реакция
3. Отвод продуктов реакции из зоны, где эта реакция протекает.
Опыт показывает, что суммарная скорость гетерогенного процесса определяется скоростью наиболее медленной стадией.
Если же скорости отдельных стадий сравнимы между собой, суммарная скорость гетерогенной реакции необязательно должна быть равна скорости самой медленной стадии т. к. все стадии взаимно связаны между собой.
Стадии, протекающие, более быстро могут оказывать влияние и на скорость самой медленной из них.
Скорость гетерогенной реакции прямопропорциональна степени дисперсности реагирующих веществ. Также скорость гетерогенных реакций находится в прямой зависимости от скорости диффузии, т.е. от скорости с которой молекулы газа или растворенного вещества поступают к зоне реакции. Рассмотрим один из простейших случаев, когда скорость реакции на поверхности равна скорости диффузии. Скорость диффузионного потока определяется первым законом Фика:
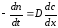
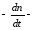 количество
вещества проходящее через данное
сечение, знак минус берется, потому что
диффузия проходит против градиента
концентрации;
количество
вещества проходящее через данное
сечение, знак минус берется, потому что
диффузия проходит против градиента
концентрации;
D- коэффициент диффузии;
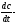 градиент
концентрации по оси X.
градиент
концентрации по оси X.
Обозначим
концентрацию реагирующего вещества
через
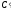 ,
тогда скорость реакции на поверхности
будет:W=
,
тогда скорость реакции на поверхности
будет:W=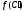 или
-D
или
-D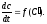
Заменим
выражение:
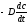 более
простым приближенным βrС:
более
простым приближенным βrС:
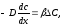 где
где
β- константа скорости диффузии, пропорциональная коэффициенту диффузии, площадь сечения / время.
rС-
конечная разность концентраций rС=С-

Скорость
химической реакции протекающей на
поверхности и имеющей первый порядок,
будет W=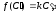 ,где
,где
к- кинетическая константа скорости.
Если
скорость диффузии равна скорости
химической реакции, то получим: β(С- )=к
)=к
Откуда
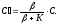
Для скорости реакции имеем:
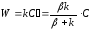
Т.о., мы выразили скорость реакции на поверхности через концентрацию вещества в объеме.
Это выражение справедливо для реакции первого порядка.
Обозначая
отношение
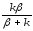 черезк* ,
получим
черезк* ,
получим
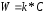
k* - связана с истинной константой химической реакции на поверхности и скоростью диффузии соотношением:
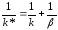
Если
скорость химической реакции значительно
больше скорости диффузии, т.е.
k
>> β,
то
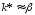 иW=βC.
иW=βC.
Следовательно, общая скорость реакции определяется скоростью диффузии. Можно сказать, что гетерогенная химическая реакция протекает в диффузионной области. Если скорость химической реакции значительно меньше скорости диффузии (к << β), то k* ≈ k и W=кС. Общая скорость реакции вновь определяется скоростью наиболее медленной стадии, т. е. скоростью химической реакции. Это кинетическая область гетерогенной реакции.
Когда к и β сравнимы друг с другом, наблюдается переходная область.
Температурная зависимость константы скорости реакции.
Наглядные
представления о зависимости скорости
химической реакции от температуры дает
правило Вант – Гоффа, согласно которому
при повышении
температуры на 10 градусов скорость
химической реакции увеличивается в 2-4
раза. Это
правило первоначально было установлено
для реакций, протекающих в растворах
при невысоких температурах, и связано
с понятием температурного коэффициента
скорости реакции γ, определяемого
соотношением:
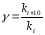
Количественная зависимость константы скорости реакции от температуры была впервые предложена Вант - Гоффом в 1827г., который, основываясь на изменении константы равновесия с температурой, указал, что подобные соотношение должно сохраняться и для константы скорости реакции.
Эта идея была развита Аррениусом, который успешно применил ее к рассмотрению большого числа реакций, поэтому следующее уравнение называют уравнением Аррениуса:
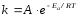 ,
где
,
где
Еа – аррениусовская, т.е. экспериментальная энергия активации.
А – предэкспоненциальный множитель
Величины Еа и А важнейшие характеристики химической реакции.
Вант – Гофф, используя уравнение, объяснил, почему наблюдающаяся зависимость имеет такой вид.
Напишем
уравнение изохоры реакции, которое
показывает зависимость константы
равновесия от температуры при
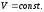
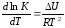 ,
где
,
где
К – константа равновесия:
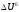 -
тепловой эффект реакции при V=const.
-
тепловой эффект реакции при V=const.
Как известно для обратимой реакции:
k1
А+В ↔С+D,
k2
идущей в газообразной фазе или в разбавленном растворе константа равновесия равна:

Запишем
тепловой эффект как разность:
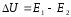 ,
тогда уравнение изохоры примет вид:
,
тогда уравнение изохоры примет вид:
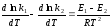
Последнее соотношение можно разбить на два уравнения:
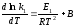 и
и
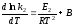 ,
где
,
где
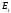 и
и
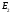 имеют размерность энергии.
имеют размерность энергии.
В - вличина, имеющая одинаковое значение для прямой и обратной реакции, В=О на основании опытных данных.
Тогда для каждой из реакций можно записать:

Так как все взаимодействия идут через стадию образования активных частиц, характеризующихся определенным значением энергии, постоянным для каждой реакции, можно заменить в уравнении Е на величину Еа и перейти к интегральной форме:
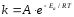
Для
объяснения физического смысла величины
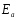 Аррениус предположил, что в реакцию
способны вступать не все частицы, а лишь
те из них, которые находятся вактивированном
состоянии.
Аррениус предположил, что в реакцию
способны вступать не все частицы, а лишь
те из них, которые находятся вактивированном
состоянии.
Молекулы в активированном состоянии возбуждении за счет избытка энергии и не устойчивы, а в нормальном - стабильны. Между нормальными и активированными молекулами существует равновесие. Доля частиц в возбужденном состоянии относительно мала. Число же частиц в нормальном состоянии практически равно общему числу частиц. Поскольку процесс активации эндотермический, то константа равновесия для этого процесса растет с увеличением температуры. Поэтому возрастает концентрация частиц в активированном состоянии и скорость реакции.
Энергию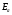 можно определить как тепловой эффект
процесса активации.
можно определить как тепловой эффект
процесса активации.
Энергия активации – это та энергия, которую должны накопить нормальные молекулы, чтобы иметь возможность прореагировать.
