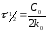- •Предисловие
- •Введение
- •Роберт Вильгельм Бунзен
- •Анри Луи Ле Шаталье
- •Вильгельм Фридрих Оствальд
- •Сванте Август Аррениус
- •Якоб Генрих Вант-Гофф
- •Иоханн Николаус Брёнстед и Михаил Ильич Усанович
- •Николай Николаевич Семенов
- •Химическая термодинамика учебно-целевые задачи – научить студентов:
- •Значимость темы
- •Основные понятия и определения химической термодинамики
- •Внутренняя энергия
- •Теплота и работа
- •Первый закон термодинамики
- •Применение I закона к простейшим процессам
- •Тепловые эффекты. Закон гесса
- •Теплоемкость
- •Второй закон термодинамики
- •Некоторые формулировки 2-го закона
- •Изменение энтропии при различных процессах
- •Пастулат планка
- •Термодинамические потенциалы
- •Соотношение между термодинамическими потенциалами
- •Закон действующих масс
- •Вопросы по теме: "термодинамика"
- •Примеры решения типовых задач
- •Пример решения контрольного задания по теме "Термодинамика"
- •Решение
- •Задачи для самостоятельной работы
- •Варианты заданий для домашней контрольной работы
- •Лабораторная работа №1.
- •Особые условия выполнения работы:
- •Устройство и настройка термометра Бекмана
- •Термодинамика фазовых превращений
- •Термодинамика фазовых равновесий
- •Основные понятия
- •Уравнение клайперона-клаузиуса
- •Диаграммы состояния однокомпонентных систем
- •Диаграмма состояния воды
- •Диаграмма состояния диоксида углерода
- •Бинарные системы Диаграммы плавкости
- •Взаимная растворимость жидкостей
- •Трехкомпонентные системы
- •Равновесие жидкость-жидкость в трехкомпонентных системах.
- •Распределение растворяемого вещества между двумя жидкими фазами. Экстракция.
- •Вопросы для подготовки к занятиям по теме: "термодинамика фазовых равновесий".
- •Примеры решения типовых задач.
- •Задачи для самостоятельной работы.
- •Лабораторная работа 1: построение диаграммы плавкости 2-х компонентной системы с простой эвтектикой.
- •Лабораторная работа № 2. Изучение взаимной растворимости фенола и воды.
- •Лабораторная работа № 3. Определение коэффициента распределения уксусной кислоты между водой и бензолом.
- •Свойства разбавленных растворов электролитов и неэлектролитов.
- •Повышение температуры кипения растворов.
- •Понижение температуру замерзания растворов.
- •Биологическое значение осмотического давления
- •Указания к выполнению работы.
- •Вопросы для самоконтроля по технике выполнения работы
- •Вопросы для самоконтроля при выполнении данного задания
- •Вопросы и задачи для самоконтроля усвоения темы
- •Вопросы для самоконтроля усвоения материала практической работы
- •Биологический статус изучаемой темы
- •Вопросы для подготовки:
- •Диссоциация воды
- •Водородный показатель
- •Механизм действия буферных систем
- •РН буферных систем
- •Влияние изменения объема буферных систем на рН.
- •Кислотно-щелочное равновесие крови
- •Роль внутренних органов в поддержании кислотно-щелочного резерва.
- •Изменение кислотно-щелочного равновесия при различных заболеваниях.
- •Задачи и задания для самостоятельной работы
- •Экспериментальная часть
- •Работа №3. Определение буферной ёмкости.
- •Электрохимия. Учебно-целевые задачи: Изучив этот раздел учебной программы, студент должен знать:
- •Значение электрохимических явлений для медицины.
- •Электродные процессы и электродвижущие силы.
- •Электрод и электродный потенциал.
- •Строение двойного электрического слоя на границе раствор-металл
- •Уравнение нернста
- •Гальванические элементы и их электродвижущие силы
- •Концентрационные гальванические элементы.
- •Диффузный потенциал.
- •Электроды первого рода.
- •Водородный электрод.
- •Ионоселективные электроды
- •Стеклянный электрод
- •Электроды второго рода.
- •Хлорсеребряный электрод Аg ׀ Ag Cl. KCl
- •Сопровождается реакцией растворения или осаждения соли АgСl:
- •Окислительно – восстановительные системы (ов) и ов –электроды.
- •Уравнение Петерса.
- •Классификация обратимых электродов.
- •Измерение эдс гальванических элементов.
- •Потенциометрия.
- •Прямые потенциометрические методы.
- •Приложение
- •Экспериментальная часть. Лабораторная работа №1. Измерение эдс гальванических элементов.
- •Порядок выполнения работы.
- •Изменение потенциалов отдельных электродов.
- •Потенциалов отдельных электродов.
- •Лабораторная работа № 3.
- •Лабораторная работа №4. Потенциометрическое измерение окислительно – восстановительных потенциалов. Редокс – системы.
- •Кинетика
- •Значение для медицины и фармации
- •Вопросы для подготовки к занятию
- •Введение
- •Понятие о скорости химического процесса
- •Основной закон химической кинетики
- •Кинетические уравнения реакций
- •Реакции первого порядка
- •Реакции второго порядка
- •Сложные реакции
- •Гетерогенные реакции
- •Температурная зависимость константы скорости реакции.
- •Методы расчета энергии активации и предэкспоненциального множителя а.
- •Основы молекулярной кинетики
- •Теория активных столкновений
- •Теория переходного состояния
- •Задачи и задания для самостоятельного решения.
- •Экспериментальная часть
- •Опыт № 1.Зависимость от концентрации.
- •Опыт №2. Зависимость от температуры
- •Учебно-методическое и информационное обеспечение дисциплины
- •По технике безопасности
- •И производственной санитарии при работе
- •В химических лабораториях
- •Медицинских учебных заведений
- •Содержание
Основной закон химической кинетики
Количественно связь между скоростью реакции и концентрациями реагирующих веществ определяется законом действующих масс:
При постоянной температуре, давлении, реакционной среде скорость химической реакции прямо пропорциональна действующим массам – молярным концентрациям реагирующих веществ, взятым в степени соответствующих стехиометрических коэффициентов.
Этот основной постулат химической кинетики вытекает из физически очевидного предположения о том, что реагируют те молекулы, которые сталкиваются. Число столкновений зависит от концентрации молекул, поэтому и скорость химической реакции должна определятся теми же факторами .Применение этого принципа приводит к общему выражению для скорости реакции, протекающей по уравнению.
аА + вВ → продукты.
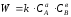 ,где
,где
k- константа скорости, она зависит от природы реагирующих веществ и температуры.
Размерность
константы скорости зависит от порядка
реакции и выражается в следующих
единицах: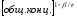 ;
β-общий порядок;
;
β-общий порядок;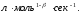
Показатели степени а и в называют порядком реакции по веществу А и В.
Сумма порядков а+в называют общим порядком реакции. Это стехиометрический порядок. Кроме стехиометрического порядка имеет место кинетический порядок, который определяется только экспериментально. Поэтому для выше приведенной реакции следует записать:
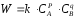 ;
;
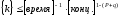
Для большинства реакций кинетические порядки не совпадают со стехиометрическими.
Порядок реакции может быть любым числом: целым, дробным, положительным и отрицательным. Возможны реакции и нулевого порядка, когда скорость реакции не зависит от концентрации. Порядок реакции зависит от механизма реакции, поэтому факторы, влияющие на механизм процесса (конц, темпер.), могут влиять на величину порядка реакции.
Важной характеристикой реакции является ее молекулярность. Для простой реакции молекулярность- это число частиц, которые согласно установленному механизму( а не по написанному уравнению) участвуют в одном элементарном акте.
Реакции бывают:
- мономолекулярными J2→J+J
- бимолекулярными CH3Br +KOH→CH3OH + KBr
- тримолекулярными 2NO + O2→2NO2
Участие в элементарном акте более трех частиц крайне маловероятно.
Кинетический порядок элементарной реакции равен ее молекулярности.
Поэтому предоставленные в качестве примера реакции соответственно будут реакциями первого, второго и третьего порядка.
Для сложных реакций, протекающих в несколько стадий, нет смысла говорить о молекулярности в целом, т. к. это понятие применимо только к отдельным стадиям.
Кинетические уравнения реакций
Рассмотрим кинетические закономерности необратимых реакций. Реакция характеризуется кинетическим уравнением, которое позволяет рассчитать константу скорости в любой момент времени от ее начала и период полупревращения.
Реакции нулевого порядка. Реакций нулевого порядка очень мало, большая их часть является гетерогенными реакциями. Нулевой порядок реакции указывает на независимость скорости реакции от концентрации реагентов.
Такая закономерность возможна когда:
- концентрация реагента поддерживается постоянной (насыщенный раствор).
- когда реакция протекает не совсем обычным путем (фотохимические, каталитические).
Для реакции А→ продукты выражение скорости как функции концентрации имеет вид:
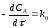
Разделив переменные получим,
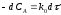
Запишем
интеграл, взяв пределы концентрации в
интервале времени (0 и
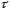 ):
):
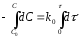
Проинтегрировав, получим:
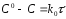 ;
;
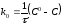 ,
,
Где
к0
- константа скорости реакции нулевого
порядка, моль/(л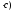
Важной
количественной характеристикой
протекания реакций во времени является
время полупревращения
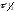 реагента.
реагента.
Эта
величина определяется промежутком
времени, в течение которого начальная
концентрация
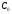 уменьшается в ходе реакции в два раза.
уменьшается в ходе реакции в два раза.
Если
уравнение кинетики реакции известно,
время полупревращения нетрудно выразить
через константу скорости. Для этого в
уравнении кинетики подставляют значения
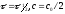 .
В результате из уравнения кинетики
реакции нулевого порядка получают:
.
В результате из уравнения кинетики
реакции нулевого порядка получают: