
- •Предисловие
- •Введение
- •Роберт Вильгельм Бунзен
- •Анри Луи Ле Шаталье
- •Вильгельм Фридрих Оствальд
- •Сванте Август Аррениус
- •Якоб Генрих Вант-Гофф
- •Иоханн Николаус Брёнстед и Михаил Ильич Усанович
- •Николай Николаевич Семенов
- •Химическая термодинамика учебно-целевые задачи – научить студентов:
- •Значимость темы
- •Основные понятия и определения химической термодинамики
- •Внутренняя энергия
- •Теплота и работа
- •Первый закон термодинамики
- •Применение I закона к простейшим процессам
- •Тепловые эффекты. Закон гесса
- •Теплоемкость
- •Второй закон термодинамики
- •Некоторые формулировки 2-го закона
- •Изменение энтропии при различных процессах
- •Пастулат планка
- •Термодинамические потенциалы
- •Соотношение между термодинамическими потенциалами
- •Закон действующих масс
- •Вопросы по теме: "термодинамика"
- •Примеры решения типовых задач
- •Пример решения контрольного задания по теме "Термодинамика"
- •Решение
- •Задачи для самостоятельной работы
- •Варианты заданий для домашней контрольной работы
- •Лабораторная работа №1.
- •Особые условия выполнения работы:
- •Устройство и настройка термометра Бекмана
- •Термодинамика фазовых превращений
- •Термодинамика фазовых равновесий
- •Основные понятия
- •Уравнение клайперона-клаузиуса
- •Диаграммы состояния однокомпонентных систем
- •Диаграмма состояния воды
- •Диаграмма состояния диоксида углерода
- •Бинарные системы Диаграммы плавкости
- •Взаимная растворимость жидкостей
- •Трехкомпонентные системы
- •Равновесие жидкость-жидкость в трехкомпонентных системах.
- •Распределение растворяемого вещества между двумя жидкими фазами. Экстракция.
- •Вопросы для подготовки к занятиям по теме: "термодинамика фазовых равновесий".
- •Примеры решения типовых задач.
- •Задачи для самостоятельной работы.
- •Лабораторная работа 1: построение диаграммы плавкости 2-х компонентной системы с простой эвтектикой.
- •Лабораторная работа № 2. Изучение взаимной растворимости фенола и воды.
- •Лабораторная работа № 3. Определение коэффициента распределения уксусной кислоты между водой и бензолом.
- •Свойства разбавленных растворов электролитов и неэлектролитов.
- •Повышение температуры кипения растворов.
- •Понижение температуру замерзания растворов.
- •Биологическое значение осмотического давления
- •Указания к выполнению работы.
- •Вопросы для самоконтроля по технике выполнения работы
- •Вопросы для самоконтроля при выполнении данного задания
- •Вопросы и задачи для самоконтроля усвоения темы
- •Вопросы для самоконтроля усвоения материала практической работы
- •Биологический статус изучаемой темы
- •Вопросы для подготовки:
- •Диссоциация воды
- •Водородный показатель
- •Механизм действия буферных систем
- •РН буферных систем
- •Влияние изменения объема буферных систем на рН.
- •Кислотно-щелочное равновесие крови
- •Роль внутренних органов в поддержании кислотно-щелочного резерва.
- •Изменение кислотно-щелочного равновесия при различных заболеваниях.
- •Задачи и задания для самостоятельной работы
- •Экспериментальная часть
- •Работа №3. Определение буферной ёмкости.
- •Электрохимия. Учебно-целевые задачи: Изучив этот раздел учебной программы, студент должен знать:
- •Значение электрохимических явлений для медицины.
- •Электродные процессы и электродвижущие силы.
- •Электрод и электродный потенциал.
- •Строение двойного электрического слоя на границе раствор-металл
- •Уравнение нернста
- •Гальванические элементы и их электродвижущие силы
- •Концентрационные гальванические элементы.
- •Диффузный потенциал.
- •Электроды первого рода.
- •Водородный электрод.
- •Ионоселективные электроды
- •Стеклянный электрод
- •Электроды второго рода.
- •Хлорсеребряный электрод Аg ׀ Ag Cl. KCl
- •Сопровождается реакцией растворения или осаждения соли АgСl:
- •Окислительно – восстановительные системы (ов) и ов –электроды.
- •Уравнение Петерса.
- •Классификация обратимых электродов.
- •Измерение эдс гальванических элементов.
- •Потенциометрия.
- •Прямые потенциометрические методы.
- •Приложение
- •Экспериментальная часть. Лабораторная работа №1. Измерение эдс гальванических элементов.
- •Порядок выполнения работы.
- •Изменение потенциалов отдельных электродов.
- •Потенциалов отдельных электродов.
- •Лабораторная работа № 3.
- •Лабораторная работа №4. Потенциометрическое измерение окислительно – восстановительных потенциалов. Редокс – системы.
- •Кинетика
- •Значение для медицины и фармации
- •Вопросы для подготовки к занятию
- •Введение
- •Понятие о скорости химического процесса
- •Основной закон химической кинетики
- •Кинетические уравнения реакций
- •Реакции первого порядка
- •Реакции второго порядка
- •Сложные реакции
- •Гетерогенные реакции
- •Температурная зависимость константы скорости реакции.
- •Методы расчета энергии активации и предэкспоненциального множителя а.
- •Основы молекулярной кинетики
- •Теория активных столкновений
- •Теория переходного состояния
- •Задачи и задания для самостоятельного решения.
- •Экспериментальная часть
- •Опыт № 1.Зависимость от концентрации.
- •Опыт №2. Зависимость от температуры
- •Учебно-методическое и информационное обеспечение дисциплины
- •По технике безопасности
- •И производственной санитарии при работе
- •В химических лабораториях
- •Медицинских учебных заведений
- •Содержание
Потенциометрия.
Потенциометрией называют совокупность физико – химических методов исследования, в основе которых лежит измерение электродвижущей силы цепей, составленных из индикаторного электрода и электрода сравнения,
Поскольку потенциал индикаторного электрода зависит от активности (концентрации) исследуемого иона в растворе, измерение ЭДС позволяет определять количество соответствующих ионов. Различают прямые и косвенные потенциометрические методы.
Прямые потенциометрические методы.
В прямых потенциометрических методах источником информации для определения активности или концентрации ионов является числовое значение индикаторного электрода. Успешное потенциометрическое определение возможно только при правильном подборе индикаторного электрода, соответствующего целям исследования.
В качестве индикаторного электрода для потенциометрического определения рН можно использовать любой электрод, потенциал которого зависит от активности ионов водорода. Чаще всего для этих целей применяют стеклянный электрод, реже – водородный.
Измерение ЭДС проводят с помощью специальных приборов – универсальных ионометров.
Косвенные потенциометрические методы.
Чаще всего потенциометрические измерения используют для определения точки эквивалентности в титриметрическом анализе – потенциометрическое титрование. В ациди- или алкалиметрии в качестве индикаторного электрода применяют стеклянный электрод , т.к. его потенциал зависит от рН среды. В оксидиметрическом титровании применяют редокс – электрод. В осадительном и комплексиметрическом – ионоселективные электроды.
Для определения точки эквивалентности строят кривую титрования (рис.12) – график зависимости ЭДС измерительной цепи от объёма прилитого титранта.
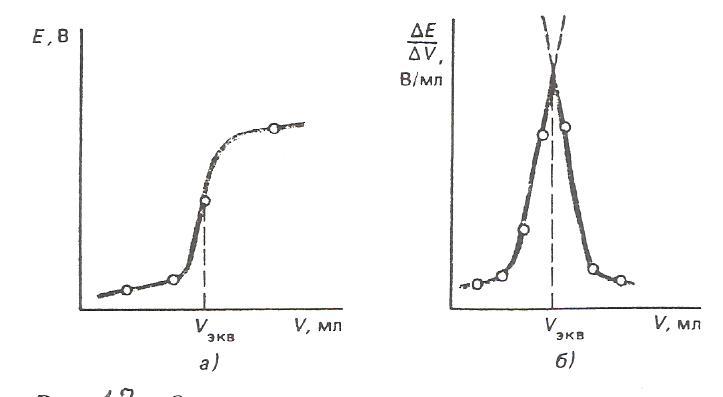
Рис.
12. Определение точки эквивалентности
в потенциометрическом титровании: а)
по графику
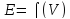 ;
б) по графику
;
б) по графику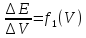
Затем проецируют точку перегиба кривой титрования на ось абсцисс (рис.12,а). Более точно искомое значение можно определить по графику изменения приращения потенциала на единицу, добавляемого объёма титранта ∆φ/ΔV в зависимости от общего объёма прилитого титранта (рис 12,б).
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ И ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ.
Задача№1:
Рассчитать потенциал кадмиевого электрода, опущенного в водный раствор сульфата кадмия с активностью ионов кадмия 0,015, при температуре 30ºС.
Решение:
Электродная реакция может быть записана следующим образом:
Cd2+ +2ē → Cd
Количество электронов, участвующих в данной электродной реакции n = 2
Равновесный электродный потенциал рассчитываем по уравнению Нернста:
RT
φ
= φº+ · ln(aCd2+),
zF
φ = -0,403+(8,314·303/2·96485)ln 0,015 = - 0,4578 B
Задание №1:
Рассчитайте потенциалы электродов при следующих условиях. Средние коэффициенты активности взять из справочника.
|
№№ |
электрод |
условия |
№№ |
электрод |
условия |
|
1-1 |
Cu2+/Cu |
m=0,1, t = 35ºC |
1-6 |
Ni2+/Ni |
m=0,05, t = 30ºC |
|
1-2 |
Cu2+/Cu |
m=1, t = 30ºC |
1-7 |
Cd2+/Cd |
m=0,1, t =25ºC |
|
1-3 |
Zn2+/Zn |
m=0,01, t =20ºC |
1-8 |
Cd2+/Cd |
m= 1,t=32ºC |
|
1-4 |
Zn2+/Zn |
m=0,1, t =28ºC |
1-9 |
Ag+/Ag |
m=0,1, t =25ºC |
|
1-5 |
Ni2+/Ni |
m= 1, t =25ºC |
1-10 |
Ag+/Ag |
m=0,01, t = 30ºC |
Задача№2
Рассчитать ЭДС гальванического элемента, составленного из полуэлементов Zn2+/Zn и Cu2+/Cu при температуре 20ºС,если активности ионов цинка и меди равны 0,1 и 0,05 соответственно.
Решение.
Zn2++ 2ē → Zn φº Zn2+/Zn = -0,763В,
Cu2+ + 2ē → Cu φº Cu2+/Cu = 0,337В.
Уравнение окислительно-восстановительной реакции записывается следующим образом:
Cu2+ + Zn → Cu + Zn2+,
следовательно, ЭДС гальванического элемента может быть рассчитана на основе уравнения Нернста по формуле:
RT
Е
=Еº
+ ln(aCu2+/aZn2+),
zF
Где Еº = φº Cu2+/Cu - φº Zn2+/Zn = 0,337 –(- 0,763) = 1,1В,
z = 2
Т = 293К
Е = 1,1 + (8,314·293/2·96500)ln(0,05/0,1) = 1,0913В
Задание №2
Рассчитайте ЭДС гальванического элемента при следующих условиях:
|
№№ |
Электрод1 |
а1 |
Электрод2 |
а2 |
Т0С |
|
2-1 |
Cu2+/Cu |
0,1 |
Cd2+/Cd |
0,15 |
20 |
|
2-2 |
Zn2+/Zn |
0,01 |
Cu2+/Cu |
0,1 |
30 |
|
2-3 |
Ni2+/Ni |
1 |
Cu2+/Cu |
0,01 |
35 |
|
2-4 |
Ag2+/Ag |
0,1 |
Zn2+/Zn |
1 |
25 |
|
2-5 |
Cu2+/Cu |
0,1 |
Cu2+/Cu |
0,01 |
30 |
|
2-6 |
Zn2+/Zn |
1 |
Zn2+/Zn |
0,15 |
25 |
|
2-7 |
Cd2+/Cd |
0,1 |
Cd2+/Cd |
1 |
30 |
Задача №3:
Как должен быть составлен гальванический элемент, чтобы в нём протекала следующая химическая реакция:
2Ag + Hg2Cl2 = 2AgCl + 2Hg.
Чему равна стандартная ЭДС элемента?
Решение.
При работе гальванического элемента серебро окисляется, а ртуть восстанавливается:
Ag – ē → Ag+
Hg22+ + 2ē → 2Hg
Следовательно, хлорсеребряный электрод – отрицательный, а каломельный – положительный. Гальванический элемент можно записать следующим образом:
Ag/AgCl,KCl//KCl,Hg2Cl2/Hg.
Стандартные потенциалы электродных реакций:
φ0Ag+/Ag = 0,222B
φ0Hg22+/Hg = 0,268B.
Стандартная ЭДС гальванического элемента:
Е0 = 0,268 – 0,222 = 0,046В
Задание 3.
Составьте гальванический элемент, чтобы в нём протекали следующие реакции и рассчитайте его ЭДС в стандартных условиях.
|
№№ |
реакция |
№№ |
реакция |
|
3-1 |
Mn + NiCl2 →MnCl2 + Ni |
3-5 |
CuCl2 + H2→ Cu + 2HCl |
|
3-2 |
Pb + CuSO4 → PbSO4 + Cu |
3-6 |
Zn +H2SO4→ ZnSO4 + H2 |
|
3-3 |
Zn + CdSO4→ Cd + ZnSO4 |
3-7 |
Cd + CuCl2→CdCl2 + Cu |
|
3-4 |
Zn + CuSO4→ Cu + ZnSO4 |
3-8 |
Cu+AgNO3→Cu(NO3)2+Ag |
Задача №4
Написать химическую реакцию, протекающую в данном гальваническом элементе в стандартных условиях:
Pt/H+,MnO4- ,Mn2+ //Co3+,Co2+ /Pt.
Решение:
В таблице стандартных потенциалов находим потенциалы электродных реакций:
MnO4- +8H+ + 5ē → Mn2+ +4H2O φ° = 1,51B,
Co3+ + ē → Co2+ φ° = 1,81B.
Следовательно на левом электроде будет происходить окисление Mn2+, а на правом – восстановление Co3+ .
Тогда протекающая в элементе реакция запишется следующим образом:
5 Co3+ + Mn2+ +4H2O = 5Co2+ +8H+ + MnO4-
Задание 4.
Написать химическую реакцию, протекающую в указанном гальваническом элементе и рассчитать его ЭДС в стандартных условиях.
|
№ |
Гальванический элемент |
№ |
|
|
4-1 |
Cd/CdSO4//H+/H2,Pt |
4-5 |
Mn/MnSO4//CoCl2/Co |
|
4-2 |
Pt,H2/HCl//CuCl2/Cu |
4-6 |
Zn/ZnSO4//H+/H2,Pt |
|
4-3 |
Zn/ZnSO4//KCl/AgCl/Ag |
4-7 |
Ag/AgCl,HCl//CuSO4/Cu |
|
4-4 |
Ni/NiCl2//AgNO3/Ag |
4-8 |
Ni/NiSO4//HCl,AgCl/Ag |
Задача 5.
Рассчитать активность ионов кобальта, если при температуре 298К ЭДС гальванического элемента
Co/CoSO4//H+/H2,Pt
составляет 0,25В.
Решение:
В гальваническом элементе протекает реакция:
2H+ + Co → H2 +Co2+.
Кобальтовый электрод является отрицательным, а водородный – положительным. Тогда ЭДС гальванического элемента:
E = φ°+ - φ-
φ - = φ°+ - E
φ°+ = 0
φ- = -E
φ(Co2+/Co) = -E = -0,25B
RT
φ(Co2+/Co)
= φ°(Co2+/Co)
+ ln(aCo2+)
zF
Решая данное уравнение относительно aCo2+,получаем: aCo2+ = 8,268
Задание№5
Рассчитать активности ионов металла в растворе, если известны потенциалы электродов.
|
№№ |
электрод |
№№ |
электрод |
|
5-1 |
φ Сd2+/Cd = -0,393B |
5-5 |
φ Co2+/Co = -0,215B |
|
5-2 |
φ Zn2+/Zn = -0,706B |
5-6 |
φ Fe2+/Fe= -0,384B |
|
5-3 |
φ Zn2+/Zn = -0,356B |
5-7 |
φ Pb2+/Pb= -0,113B |
|
5-4 |
φNi2+/Ni = -0,220B |
5-8 |
φ Ag+/Ag = 0,810B |
Задача 6:
Рассчитать произведение растворимости хлорида меди при Т = 298 К, если стандартный потенциал электрода Cl-/CuCl/Cu φ0Cl-/CuCl/Cu = 0,137В, а стандартный потенциал медного электрода φ0Cu2+/Cu =0,521 В.
Решение:
На электроде протекает реакция:
CuCl + ē → Cu + Cl-
Стандартный потенциал электрода второго рода:
RT
φ
= φ0
Cu+/Cu
+ ln(aCu2+)
zF
ПР = aCu+ · aCl-, aCu+ = ПР/ aCl-,
RT RT
φ
= φ0
Cu+/Cu
+ ln·ПР
- ·ln(aCl-),
zF zF
или
RT
φ
= φ0Сl-/CuCl/Cu
- ·ln(aCl-),
zF
RT
φ0Сl-/CuCl/Cu
=
φ0Сu+/Cu
+ ·lnПР.
zF
Из последнего соотношения выражаем значение ПР и подставляем числовые значения:
lnПР = -14,94,
ПР = 3,19 · 10-7
Задание 6.
Рассчитать ПР соединений, если известны потенциалы электродов второго рода.
|
№№ |
соединение |
электрод |
φ0, В |
|
6-1 |
AgCl |
Cl-/AgCl/Ag |
0,222 |
|
6-2 |
PbSO4 |
SO42-/PbSO4/Pb |
-0,351 |
|
6-3 |
Hg2SO4 |
SO42-/Hg2SO4/Hg |
0,615 |
|
6-4 |
CuCl |
Cl-/CuCl/Cu |
0,153 |
|
6-5 |
Hg2Cl2 |
Cl-/Hg2Cl2/Hg |
0,268 |
|
6-6 |
PbI2 |
I-/PbI2/Pb |
-0,365 |
|
6-7 |
ZnS |
S2-/ZnS/Zn |
-1,405 |
|
6-8 |
Ni(OH)2 |
OH-/Ni(OH)2/Ni |
-0,720 |
