
- •Предисловие
- •Введение
- •Роберт Вильгельм Бунзен
- •Анри Луи Ле Шаталье
- •Вильгельм Фридрих Оствальд
- •Сванте Август Аррениус
- •Якоб Генрих Вант-Гофф
- •Иоханн Николаус Брёнстед и Михаил Ильич Усанович
- •Николай Николаевич Семенов
- •Химическая термодинамика учебно-целевые задачи – научить студентов:
- •Значимость темы
- •Основные понятия и определения химической термодинамики
- •Внутренняя энергия
- •Теплота и работа
- •Первый закон термодинамики
- •Применение I закона к простейшим процессам
- •Тепловые эффекты. Закон гесса
- •Теплоемкость
- •Второй закон термодинамики
- •Некоторые формулировки 2-го закона
- •Изменение энтропии при различных процессах
- •Пастулат планка
- •Термодинамические потенциалы
- •Соотношение между термодинамическими потенциалами
- •Закон действующих масс
- •Вопросы по теме: "термодинамика"
- •Примеры решения типовых задач
- •Пример решения контрольного задания по теме "Термодинамика"
- •Решение
- •Задачи для самостоятельной работы
- •Варианты заданий для домашней контрольной работы
- •Лабораторная работа №1.
- •Особые условия выполнения работы:
- •Устройство и настройка термометра Бекмана
- •Термодинамика фазовых превращений
- •Термодинамика фазовых равновесий
- •Основные понятия
- •Уравнение клайперона-клаузиуса
- •Диаграммы состояния однокомпонентных систем
- •Диаграмма состояния воды
- •Диаграмма состояния диоксида углерода
- •Бинарные системы Диаграммы плавкости
- •Взаимная растворимость жидкостей
- •Трехкомпонентные системы
- •Равновесие жидкость-жидкость в трехкомпонентных системах.
- •Распределение растворяемого вещества между двумя жидкими фазами. Экстракция.
- •Вопросы для подготовки к занятиям по теме: "термодинамика фазовых равновесий".
- •Примеры решения типовых задач.
- •Задачи для самостоятельной работы.
- •Лабораторная работа 1: построение диаграммы плавкости 2-х компонентной системы с простой эвтектикой.
- •Лабораторная работа № 2. Изучение взаимной растворимости фенола и воды.
- •Лабораторная работа № 3. Определение коэффициента распределения уксусной кислоты между водой и бензолом.
- •Свойства разбавленных растворов электролитов и неэлектролитов.
- •Повышение температуры кипения растворов.
- •Понижение температуру замерзания растворов.
- •Биологическое значение осмотического давления
- •Указания к выполнению работы.
- •Вопросы для самоконтроля по технике выполнения работы
- •Вопросы для самоконтроля при выполнении данного задания
- •Вопросы и задачи для самоконтроля усвоения темы
- •Вопросы для самоконтроля усвоения материала практической работы
- •Биологический статус изучаемой темы
- •Вопросы для подготовки:
- •Диссоциация воды
- •Водородный показатель
- •Механизм действия буферных систем
- •РН буферных систем
- •Влияние изменения объема буферных систем на рН.
- •Кислотно-щелочное равновесие крови
- •Роль внутренних органов в поддержании кислотно-щелочного резерва.
- •Изменение кислотно-щелочного равновесия при различных заболеваниях.
- •Задачи и задания для самостоятельной работы
- •Экспериментальная часть
- •Работа №3. Определение буферной ёмкости.
- •Электрохимия. Учебно-целевые задачи: Изучив этот раздел учебной программы, студент должен знать:
- •Значение электрохимических явлений для медицины.
- •Электродные процессы и электродвижущие силы.
- •Электрод и электродный потенциал.
- •Строение двойного электрического слоя на границе раствор-металл
- •Уравнение нернста
- •Гальванические элементы и их электродвижущие силы
- •Концентрационные гальванические элементы.
- •Диффузный потенциал.
- •Электроды первого рода.
- •Водородный электрод.
- •Ионоселективные электроды
- •Стеклянный электрод
- •Электроды второго рода.
- •Хлорсеребряный электрод Аg ׀ Ag Cl. KCl
- •Сопровождается реакцией растворения или осаждения соли АgСl:
- •Окислительно – восстановительные системы (ов) и ов –электроды.
- •Уравнение Петерса.
- •Классификация обратимых электродов.
- •Измерение эдс гальванических элементов.
- •Потенциометрия.
- •Прямые потенциометрические методы.
- •Приложение
- •Экспериментальная часть. Лабораторная работа №1. Измерение эдс гальванических элементов.
- •Порядок выполнения работы.
- •Изменение потенциалов отдельных электродов.
- •Потенциалов отдельных электродов.
- •Лабораторная работа № 3.
- •Лабораторная работа №4. Потенциометрическое измерение окислительно – восстановительных потенциалов. Редокс – системы.
- •Кинетика
- •Значение для медицины и фармации
- •Вопросы для подготовки к занятию
- •Введение
- •Понятие о скорости химического процесса
- •Основной закон химической кинетики
- •Кинетические уравнения реакций
- •Реакции первого порядка
- •Реакции второго порядка
- •Сложные реакции
- •Гетерогенные реакции
- •Температурная зависимость константы скорости реакции.
- •Методы расчета энергии активации и предэкспоненциального множителя а.
- •Основы молекулярной кинетики
- •Теория активных столкновений
- •Теория переходного состояния
- •Задачи и задания для самостоятельного решения.
- •Экспериментальная часть
- •Опыт № 1.Зависимость от концентрации.
- •Опыт №2. Зависимость от температуры
- •Учебно-методическое и информационное обеспечение дисциплины
- •По технике безопасности
- •И производственной санитарии при работе
- •В химических лабораториях
- •Медицинских учебных заведений
- •Содержание
Задачи и задания для самостоятельной работы
Задача №1.
Вычислите концентрацию ионов гидроксила (OH- ) в моче при pH=6
Решение:
pOH+pH=14
Отсюда
pOH=-lg a(OH- )
8=-lg a(OH-) -8
a(OH-) = антилогарифм(-8)=10
Задание 1
Вычислите концентрацию ионов гидроксила в биологических объектах при указанных значениях pH
|
Биологические объекты |
рН |
Биологические объекты |
рН |
|
Сыворотка крови |
7.4 |
Желудочный сок |
1 |
|
Слюна |
6.5 |
Спинно-мозговая жидкость |
7.45 |
|
Молоко |
6,8 |
Желчь в пузыре |
5,8 |
|
Содержимое тонкого кишечника |
8,0 |
Слезная жидкость |
7,5 |
|
Желчь в протоках |
7,8 |
Сок поджелудочной железы |
7,6 |
|
Печень |
6,9 |
Кожа |
6,4 |
Задача №2.
Рассчитайте pH ацетатной буферной смеси, состоящей из 100 мл 0,1моль/л CH3COOH и 200 мл 0,2 моль/л CH3COONa, pKCH3COOH=4,76.
Решение:
Для расчётов воспользуемся уравнением Гендерсона-Гассельбаха:
С(1/zCH3COONa)*V(CH3COONa)
pH=pKCH3COOH
+ lg
;
C(1/zCH3COOH)*V(CH3COOH)
pH=4,76+lg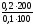 =4,76+lg4=4,76+0,6021=5,3621
=4,76+lg4=4,76+0,6021=5,3621
Задание 2.
Рассчитайте pH буферных смесей при заданных условиях и определите в каких пределах изменяется их pH.
|
буферная смесь |
pK |
объем, мл |
Концентрация, Моль/л | ||
|
Соли |
Кислоты |
Соли |
Кислоты | ||
|
Ацетатная |
4,76 |
1,0 |
4,0 |
0,1 |
0,1 |
|
4,76 |
2,5 |
2,5 |
0,1 |
0,1 | |
|
4,76 |
3,5 |
1,5 |
0,1 |
0,1 | |
|
4,76 |
4,0 |
1,0 |
0,1 |
0,1 | |
|
4,76 |
4,5 |
0,5 |
0,1 |
0,1 | |
|
Фосфатная |
6.86 |
1,0 |
4,0 |
0,02 |
0,02 |
|
6.86 |
2,5 |
2,5 |
0,02 |
0,02 | |
|
6.86 |
3,5 |
1,5 |
0,02 |
0,02 | |
|
6.86 |
4,0 |
1,0 |
0,02 |
0,02 | |
|
6.86 |
4,5 |
0,5 |
0,02 |
0,02 | |
Задача №3.
Вычислите соотношение концентрации CH3COONa и CH3COOH в буферном растворе с pH, равным 5,8.
Решение:
В соответствии с уравнением Гендерсона-Гассельбаха:
pH=pK(к)+lg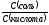 .
.
Отсюда
lg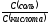 =pH-pK(к)=5,8-4,8=1,0
=pH-pK(к)=5,8-4,8=1,0
Тогда
 =антилогарифм(1,0)=10
=антилогарифм(1,0)=10
Задание 3.
Рассчитайте соотношение концентраций компонентов буферных систем для указанных значений pH.
|
Буферные системы |
Состав буферных систем |
Кд(кислоты) |
pH |
|
Ацетатная |
_ CH3COO/CH3COOH |
1,75*10-5 |
5,7 |
|
Ацетатная |
_ CH3COO/CH3COOH |
3,0*10-5
|
5,12 |
|
Гидрокарбонатная |
_ HCO3/H2CO3 |
4,4*10-7 |
7,66 |
|
Фосфатная |
_ HPO42-/H2PO4 |
1,6*10-7
|
7,4 |
|
Гемоглобиновая |
_ Hв/HHв |
6,31*10-9 |
7,36
|
|
Цитратная
|
H2C6H5O7/H3C6H5O7
|
1,2*10-3 |
4,15 |
Задача №4.
К 100 мл крови для изменения pH от 7,36 до 7,0 надо добавить 36 мл 0,005 м раствора HCl.
Математически буферная ёмкость определяется следующим образом.
Буферная ёмкость по кислоте (моль/л):
Вк.=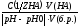 ;
;
Буферная ёмкость по щёлочи(моль/л):
Вщ.=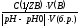 ;
;
V(HA),V(B)-объёмы добавленных кислоты HA или щёлочи B соответственно л;
C(1/zHA), C(1/zB)-молярные концентрации соответственно эквивалента кислоты и щёлочи.
V(б.р.)-объём буферного раствора, л.
pH0, pH-значение pH буферного раствора до и после добавления кислоты или щёлочи.
Задание 4.
Рассчитайте буферную ёмкость по кислоте Вк буферных систем крови.
|
Буферная смесь |
Vб.р.,мл |
pH0 |
pH |
V(HA), мл |
C(1/zHA) моль/л |
|
Гидрокарбонатная буферная система крови |
20 |
7,40 |
7,04 |
14 |
0,02 |
|
50 |
7,38 |
7,28 |
2 |
0,1 | |
|
100 |
7,4 |
7,20 |
16 |
0,05 | |
|
Фосфатная буферная система крови |
20 |
7,38 |
7,06 |
2 |
0,005 |
|
50 |
7,40 |
7,10 |
6 |
0,005 | |
|
100 |
7,38 |
7,02 |
5 |
0,01 |
Рассчитайте буферную ёмкость по щёлочи Вщ буферных систем крови.
|
Буферная смесь |
Vб.р.,мл |
pH0 |
pH |
V(HA), мл |
C(1/zHA) моль/л |
|
Гидрокарбонатная буферная система крови |
20 |
7,4 |
7,04 |
3 |
0,005 |
|
50 |
7,4 |
7,00 |
4 |
0,01 | |
|
100 |
7,38 |
7,18 |
8 |
0,005 | |
|
Фосфатная буферная система крови |
50 |
7,36 |
7,00 |
1,8 |
0,005 |
|
100 |
7,38 |
7,08 |
1,5 |
0,01 | |
|
150 |
7,40 |
7,14 |
2 |
0,01 |
Для проверки своих результатов воспользуйтесь литературными данными.
|
Буферная смесь |
Вк., моль/л |
Вщ., моль/л |
|
Гидрокарбонатная буферная система плазмы крови |
40 |
1-2 |
|
Фосфатная буферная система плазма крови |
1-2 |
0,5 |
