
- •Предисловие
- •Введение
- •Роберт Вильгельм Бунзен
- •Анри Луи Ле Шаталье
- •Вильгельм Фридрих Оствальд
- •Сванте Август Аррениус
- •Якоб Генрих Вант-Гофф
- •Иоханн Николаус Брёнстед и Михаил Ильич Усанович
- •Николай Николаевич Семенов
- •Химическая термодинамика учебно-целевые задачи – научить студентов:
- •Значимость темы
- •Основные понятия и определения химической термодинамики
- •Внутренняя энергия
- •Теплота и работа
- •Первый закон термодинамики
- •Применение I закона к простейшим процессам
- •Тепловые эффекты. Закон гесса
- •Теплоемкость
- •Второй закон термодинамики
- •Некоторые формулировки 2-го закона
- •Изменение энтропии при различных процессах
- •Пастулат планка
- •Термодинамические потенциалы
- •Соотношение между термодинамическими потенциалами
- •Закон действующих масс
- •Вопросы по теме: "термодинамика"
- •Примеры решения типовых задач
- •Пример решения контрольного задания по теме "Термодинамика"
- •Решение
- •Задачи для самостоятельной работы
- •Варианты заданий для домашней контрольной работы
- •Лабораторная работа №1.
- •Особые условия выполнения работы:
- •Устройство и настройка термометра Бекмана
- •Термодинамика фазовых превращений
- •Термодинамика фазовых равновесий
- •Основные понятия
- •Уравнение клайперона-клаузиуса
- •Диаграммы состояния однокомпонентных систем
- •Диаграмма состояния воды
- •Диаграмма состояния диоксида углерода
- •Бинарные системы Диаграммы плавкости
- •Взаимная растворимость жидкостей
- •Трехкомпонентные системы
- •Равновесие жидкость-жидкость в трехкомпонентных системах.
- •Распределение растворяемого вещества между двумя жидкими фазами. Экстракция.
- •Вопросы для подготовки к занятиям по теме: "термодинамика фазовых равновесий".
- •Примеры решения типовых задач.
- •Задачи для самостоятельной работы.
- •Лабораторная работа 1: построение диаграммы плавкости 2-х компонентной системы с простой эвтектикой.
- •Лабораторная работа № 2. Изучение взаимной растворимости фенола и воды.
- •Лабораторная работа № 3. Определение коэффициента распределения уксусной кислоты между водой и бензолом.
- •Свойства разбавленных растворов электролитов и неэлектролитов.
- •Повышение температуры кипения растворов.
- •Понижение температуру замерзания растворов.
- •Биологическое значение осмотического давления
- •Указания к выполнению работы.
- •Вопросы для самоконтроля по технике выполнения работы
- •Вопросы для самоконтроля при выполнении данного задания
- •Вопросы и задачи для самоконтроля усвоения темы
- •Вопросы для самоконтроля усвоения материала практической работы
- •Биологический статус изучаемой темы
- •Вопросы для подготовки:
- •Диссоциация воды
- •Водородный показатель
- •Механизм действия буферных систем
- •РН буферных систем
- •Влияние изменения объема буферных систем на рН.
- •Кислотно-щелочное равновесие крови
- •Роль внутренних органов в поддержании кислотно-щелочного резерва.
- •Изменение кислотно-щелочного равновесия при различных заболеваниях.
- •Задачи и задания для самостоятельной работы
- •Экспериментальная часть
- •Работа №3. Определение буферной ёмкости.
- •Электрохимия. Учебно-целевые задачи: Изучив этот раздел учебной программы, студент должен знать:
- •Значение электрохимических явлений для медицины.
- •Электродные процессы и электродвижущие силы.
- •Электрод и электродный потенциал.
- •Строение двойного электрического слоя на границе раствор-металл
- •Уравнение нернста
- •Гальванические элементы и их электродвижущие силы
- •Концентрационные гальванические элементы.
- •Диффузный потенциал.
- •Электроды первого рода.
- •Водородный электрод.
- •Ионоселективные электроды
- •Стеклянный электрод
- •Электроды второго рода.
- •Хлорсеребряный электрод Аg ׀ Ag Cl. KCl
- •Сопровождается реакцией растворения или осаждения соли АgСl:
- •Окислительно – восстановительные системы (ов) и ов –электроды.
- •Уравнение Петерса.
- •Классификация обратимых электродов.
- •Измерение эдс гальванических элементов.
- •Потенциометрия.
- •Прямые потенциометрические методы.
- •Приложение
- •Экспериментальная часть. Лабораторная работа №1. Измерение эдс гальванических элементов.
- •Порядок выполнения работы.
- •Изменение потенциалов отдельных электродов.
- •Потенциалов отдельных электродов.
- •Лабораторная работа № 3.
- •Лабораторная работа №4. Потенциометрическое измерение окислительно – восстановительных потенциалов. Редокс – системы.
- •Кинетика
- •Значение для медицины и фармации
- •Вопросы для подготовки к занятию
- •Введение
- •Понятие о скорости химического процесса
- •Основной закон химической кинетики
- •Кинетические уравнения реакций
- •Реакции первого порядка
- •Реакции второго порядка
- •Сложные реакции
- •Гетерогенные реакции
- •Температурная зависимость константы скорости реакции.
- •Методы расчета энергии активации и предэкспоненциального множителя а.
- •Основы молекулярной кинетики
- •Теория активных столкновений
- •Теория переходного состояния
- •Задачи и задания для самостоятельного решения.
- •Экспериментальная часть
- •Опыт № 1.Зависимость от концентрации.
- •Опыт №2. Зависимость от температуры
- •Учебно-методическое и информационное обеспечение дисциплины
- •По технике безопасности
- •И производственной санитарии при работе
- •В химических лабораториях
- •Медицинских учебных заведений
- •Содержание
Изменение кислотно-щелочного равновесия при различных заболеваниях.
При различных заболеваниях наблюдается сдвиг рН биологических сред. Как показывают исследования, отклонения рН в первую очередь отражаются на активности ферментов, нарушая нормальный ритм реакции в клетке.
В последнее время выявлены нарушения кислотно-щелочного равновесия при различных сердечно-сосудистых заболеваниях. Показано, что при ишемической болезни сердца закономерным является возникновение ацидоза. Сдвиги рН в кислую область возникают у больных с обширной зоной повреждения сердца - крупноочаговым инфарктом миокарда. Одновременно наблюдается снижение концентрации ионов калия в плазме и эритроцитах. Перемещение ионов H+ в клетку приводит к снижению рН внутри клетки. Следовательно, при инфаркте миокарда с выраженным метаболическим ацидозом следует ожидать сдвига в щелочную область рН во внеклеточном пространстве, что наблюдается на практике. Для увеличения эффективности лечения необходимо возместить дефицит ионов К+ в миокарде и одновременно нейтрализовать ионы Н+ в плазме и в межклеточном пространстве. Это достигается введением растворов калия внутривенно. Сахарный диабет является тяжелым и распространенным заболеванием современного человечества. Нарушение кислотно-щелочного равновесия при сахарном диабете происходит из-за чрезмерного накопления ионов в межклеточной жидкости. Ионы К+ в клетке замещаются ионами Na+ и Н+.У больных, страдающих тяжелой формой сахарного диабета, наблюдается сдвиг рН в кислую область (ацидоз). У больных с легкой формой сахарного диабета отклонения рН от нормы, как правило, не наблюдается. Изучение кислотно-щелочного равновесия при диабете позволило установить некоторые закономерности между течением этого заболевания и изменением рН крови. Что в свою очередь позволяет проводить направленное лечение для устранения этих нарушений. Изменение кислотно-щелочного состояния широко изучается при заболеваниях органов пищеварения. При болезнях желудка часто возникают нарушения в кислотно-щелочном равновесии, главным образом по механизму ацидоза. Исследования смещения кислотно-щелочного равновесия при заболеваниях печени (цирроз печени и т.д.) показали на смещение рН в щелочную область (рН от 7,3 до 7,6) Кислотно-щелочное равновесие внутренних сред организма определяет в ряде случаев восприимчивость организмов к инфекционным заболеваниям. Особенно показателен в этом отношении пример с холерой.
Возбудители холеры - холерные вибрионы - относяться к группе «щелочнолюбивых» микробов (галофилов). Оптимум рН для их размножения 7,6-9,2. Кислоты, даже при разведении 1 : 10 000, губительны для вибрионов, иными словами, холерный вибрион обладает исключительной чувствительностью к кислотам. Как известно, заражение холерой происходит обычно при употреблении воды, содержащей холерные вибрионы, Человек с кислотообразующей функцией желудка практически не может заразится холерой, даже находясь в очаге инфекции. Развитию холеры способствуют следующие факторы:
резкое снижение и даже отсутствие кислотности в желудочном содержимом (при некоторых болезнях желудка, различных стрессах, в том числе перегревании, психическом переутомлении);
характер пищи; особенно «неблагоприятна» в этом отношении белковая пища, являющаяся мощным буфером;
привычка запивать пищу водой, особенно минеральными щелочными водами (типа «Боржоми»), которые «разводят» желудочный сок и даже нейтрализуют его.
Наиболее благоприятны для длительного выживания и размножения холерных вибрионов водоемы с высокой степенью фекального загрязнения, воды которых более щелочные. Имеют значения и структуры почв водоемов.
Болезнетворное действие холерных микробов состоит в нарушении активного переноса ионов Na+ в клетках слизистой оболочки кишечника. Вследствие этого резко замедляется или выключается реадсорбция натрия (из полости кишки в кровь), нарушается изотония и происходят стремительные потери ионов Na+, К+, НСОз -, Сl- Вслед за этим в просвет кишечника устремляется вода - до 1 л. в час. Самые тяжелые и опасные для жизни явления при холере обусловлены развитием некомпенсированного метаболического ацидоза и обезвоживания. Больные погибают, когда сдвиги водно-электролитного и кислотно-щелочного равновесия достигают несовместимых с жизнью степеней, которые невозможно преодолеть современными лекарствами. Все перечисленное об условиях, способствующих развитию холеры, в большой степени справедливо и для других острых кишечных инфекций, в частности дизентерии.
Чтобы изучение названной темы не было однобоким, необходимо сделать акцент на значении буферных систем для аналитической практики. Некоторые реакции протекают в строго определенном диапазоне рН, который и обеспечивают буферные системы. Способность буферных систем стойко удерживать на определенном уровне концентрацию ионов водорода является ограниченной и оценивается буферной емкостью.
Величину, характеризующую способность буферного раствора противодействовать смещению реакции среды при добавлении кислот или щелочей, называют буферной емкостью раствора.
Буферная емкость В измеряется количеством кислоты или щелочи (моль-или моль эквивалента), добавление которого к 1л. буферного раствора изменяет рН на единицу.
Математически буферная емкость определяется следующим образом:
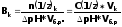 -
буферная емкость по кислоте
-
буферная емкость по кислоте
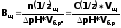 -
буферная емкость по щелочи
-
буферная емкость по щелочи
Vk, Vщ - объемы добавленной кислоты или щелочи;
n(l/z)k, n(l/z)щ - количество моль-эквивалента кислоты или щелочи;
С(1/z)k, C(l/z)щ - молярные концентрации эквивалента кислоты или щелочи;
Vб.р. - объем буферного раствора;
(ΔрН) - разность рН по модулю.
Наибольшей буферной емкостью обладают концентрированные буферные растворы. Из буферных растворов с равной концентрацией наибольшей емкостью обладают те, которые составлены из равного количества компонентов, т.е. соотношение С(кислота) / С(соли) должно быть равно единице.
Изменение рН ацетатной буферной смеси в зависимости от соотношения кислоты соли при добавлении НСl или NaOH показаны в таблице 4.
Таблица 4.
|
Исходные СНзСООН: CHзCOONa |
рН |
Добавлено 5 мг-экв. |
Конечные СНзСООН: CHзCOONa |
рН |
рН |
|
94:6=15,7 |
3,53 |
НСl |
99:1 |
2.43 |
0,80 |
|
90:10=9,0 |
3,78 |
НСl |
95:5 |
3.45 |
0,33 |
|
85:15=5,67 |
3,98 |
НСl |
90:10 |
3.78 |
0.20 |
|
75:25=3,0 |
4,25 |
НСl |
80:20 |
4.13 |
0,12 |
|
50:50=1,0 |
4,74 |
НСl |
55:45 |
4.66 |
0,08 |
|
50:50=1,0 |
4,74 |
NaOH |
45:55 |
4.82 |
0,08 |
|
25:75=0,33 |
5,21 |
NaOH |
20:80 |
5.33 |
0,12 |
|
15:85=0,18 |
5,48 |
NaOH |
10:90 |
5.68 |
0,20 |
|
10:90=0,11 |
5,68 |
NaOH |
5:95 |
6.01 |
0,33 |
|
6:94=0,063 |
5,93 |
NaOH |
1:99 |
6.73 |
0,80 |
