
- •Предисловие
- •Введение
- •Роберт Вильгельм Бунзен
- •Анри Луи Ле Шаталье
- •Вильгельм Фридрих Оствальд
- •Сванте Август Аррениус
- •Якоб Генрих Вант-Гофф
- •Иоханн Николаус Брёнстед и Михаил Ильич Усанович
- •Николай Николаевич Семенов
- •Химическая термодинамика учебно-целевые задачи – научить студентов:
- •Значимость темы
- •Основные понятия и определения химической термодинамики
- •Внутренняя энергия
- •Теплота и работа
- •Первый закон термодинамики
- •Применение I закона к простейшим процессам
- •Тепловые эффекты. Закон гесса
- •Теплоемкость
- •Второй закон термодинамики
- •Некоторые формулировки 2-го закона
- •Изменение энтропии при различных процессах
- •Пастулат планка
- •Термодинамические потенциалы
- •Соотношение между термодинамическими потенциалами
- •Закон действующих масс
- •Вопросы по теме: "термодинамика"
- •Примеры решения типовых задач
- •Пример решения контрольного задания по теме "Термодинамика"
- •Решение
- •Задачи для самостоятельной работы
- •Варианты заданий для домашней контрольной работы
- •Лабораторная работа №1.
- •Особые условия выполнения работы:
- •Устройство и настройка термометра Бекмана
- •Термодинамика фазовых превращений
- •Термодинамика фазовых равновесий
- •Основные понятия
- •Уравнение клайперона-клаузиуса
- •Диаграммы состояния однокомпонентных систем
- •Диаграмма состояния воды
- •Диаграмма состояния диоксида углерода
- •Бинарные системы Диаграммы плавкости
- •Взаимная растворимость жидкостей
- •Трехкомпонентные системы
- •Равновесие жидкость-жидкость в трехкомпонентных системах.
- •Распределение растворяемого вещества между двумя жидкими фазами. Экстракция.
- •Вопросы для подготовки к занятиям по теме: "термодинамика фазовых равновесий".
- •Примеры решения типовых задач.
- •Задачи для самостоятельной работы.
- •Лабораторная работа 1: построение диаграммы плавкости 2-х компонентной системы с простой эвтектикой.
- •Лабораторная работа № 2. Изучение взаимной растворимости фенола и воды.
- •Лабораторная работа № 3. Определение коэффициента распределения уксусной кислоты между водой и бензолом.
- •Свойства разбавленных растворов электролитов и неэлектролитов.
- •Повышение температуры кипения растворов.
- •Понижение температуру замерзания растворов.
- •Биологическое значение осмотического давления
- •Указания к выполнению работы.
- •Вопросы для самоконтроля по технике выполнения работы
- •Вопросы для самоконтроля при выполнении данного задания
- •Вопросы и задачи для самоконтроля усвоения темы
- •Вопросы для самоконтроля усвоения материала практической работы
- •Биологический статус изучаемой темы
- •Вопросы для подготовки:
- •Диссоциация воды
- •Водородный показатель
- •Механизм действия буферных систем
- •РН буферных систем
- •Влияние изменения объема буферных систем на рН.
- •Кислотно-щелочное равновесие крови
- •Роль внутренних органов в поддержании кислотно-щелочного резерва.
- •Изменение кислотно-щелочного равновесия при различных заболеваниях.
- •Задачи и задания для самостоятельной работы
- •Экспериментальная часть
- •Работа №3. Определение буферной ёмкости.
- •Электрохимия. Учебно-целевые задачи: Изучив этот раздел учебной программы, студент должен знать:
- •Значение электрохимических явлений для медицины.
- •Электродные процессы и электродвижущие силы.
- •Электрод и электродный потенциал.
- •Строение двойного электрического слоя на границе раствор-металл
- •Уравнение нернста
- •Гальванические элементы и их электродвижущие силы
- •Концентрационные гальванические элементы.
- •Диффузный потенциал.
- •Электроды первого рода.
- •Водородный электрод.
- •Ионоселективные электроды
- •Стеклянный электрод
- •Электроды второго рода.
- •Хлорсеребряный электрод Аg ׀ Ag Cl. KCl
- •Сопровождается реакцией растворения или осаждения соли АgСl:
- •Окислительно – восстановительные системы (ов) и ов –электроды.
- •Уравнение Петерса.
- •Классификация обратимых электродов.
- •Измерение эдс гальванических элементов.
- •Потенциометрия.
- •Прямые потенциометрические методы.
- •Приложение
- •Экспериментальная часть. Лабораторная работа №1. Измерение эдс гальванических элементов.
- •Порядок выполнения работы.
- •Изменение потенциалов отдельных электродов.
- •Потенциалов отдельных электродов.
- •Лабораторная работа № 3.
- •Лабораторная работа №4. Потенциометрическое измерение окислительно – восстановительных потенциалов. Редокс – системы.
- •Кинетика
- •Значение для медицины и фармации
- •Вопросы для подготовки к занятию
- •Введение
- •Понятие о скорости химического процесса
- •Основной закон химической кинетики
- •Кинетические уравнения реакций
- •Реакции первого порядка
- •Реакции второго порядка
- •Сложные реакции
- •Гетерогенные реакции
- •Температурная зависимость константы скорости реакции.
- •Методы расчета энергии активации и предэкспоненциального множителя а.
- •Основы молекулярной кинетики
- •Теория активных столкновений
- •Теория переходного состояния
- •Задачи и задания для самостоятельного решения.
- •Экспериментальная часть
- •Опыт № 1.Зависимость от концентрации.
- •Опыт №2. Зависимость от температуры
- •Учебно-методическое и информационное обеспечение дисциплины
- •По технике безопасности
- •И производственной санитарии при работе
- •В химических лабораториях
- •Медицинских учебных заведений
- •Содержание
Механизм действия буферных систем
Если в организм вводится условно сильная кислота, например, соляная, то при попадании ее в кровь будет происходить реакция нейтрализации с участием бикарбонатов металлов:
NaHCО3 + НСl = NaCI + Н2СО3 (1)
Как видно из уравнения (1) сильная кислота (НСl) заменяется эквивалентным количеством слабой кислоты (Н2СО3). В соответствии с законом Оствальда повышение концентрации угольной кислоты понижает, и так небольшую (0,011%), степень ее диссоциации. В результате этого концентрация поступающих в кровь извне, ионов Н+ не достигает значительных величин.
При введении в организм другого «агрессора», например, сильного основания (NaOH), концентрация водородных ионов и рН изменится также незначительно. Щелочь при этом будет реагировать с другим компонентом буфера (Н2СО3) по реакции нейтрализации:
Н 2СО 3 + NaOH = NaHCО3 + Н2О (2)
В результате этого добавленная щелочь заменяется эквивалентным количеством слабоосновной соли, в меньшей степени влияющей на реакцию среды. Анионы HCО3-,образующиеся при диссоциации этой соли, будут оказывать некоторое угнетающее действие на диссоциацию угольной кислоты.
В процессе этой реакции расходуется угольная кислота, и можно было ожидать значительное снижение содержания ионов Н+. Однако, активная кислотность смеси почти не изменяется, т к вместо прореагировавших ионов кислоты (Н + и НСО3-) за счет потенциальной кислотности образуются новые ионы Н + и НСО3-.
Для врача наиболее ценным являются сведения о количественной характеристике всех буферных систем и особенно бикарбонатной.
Расчетное уравнение рН крови по бикарбонатному буферу можно получить из уравнения Гендерсона - Гассельбаха, вывод которого представлен ниже.
РН буферных систем
Согласно закону действующих масс константа диссоциации угольной кислоты будет:
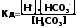 (2)
(2)
откуда
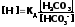 (3)
(3)
Слабая диссоциация угольной кислоты еще в большей степени подавляется при добавлении хорошо диссоциирующей соли (NaHCO3). Практически концентрация недиссоциированных молекул H2CO3 может быть принята равной общей концентрации кислоты. Так как, соль полностью диссоциирует, можно принять общую концентрацию аниона равной концентрации соли в буферном растворе. Исходя из этого уравнение (3) можно представить в следующем виде:
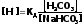 (4)
(4)
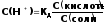 (4)
(4)
Логарифмируя уравнение (4) с обратным знаком, получаем основное расчетное уравнение теории буферных растворов - уравнение Гендерсона - Гассельбаха:
рН
= -lgК
– lg
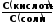 или
или
рН
= рК -lg
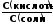
Для основного буфера, каким является, например, аммиачный, соответственно будет:
рН
= рК -lg
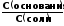
рН
= 14 - рК + lg
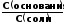
Из приведенных уравнений видно, что рН буферных смесей зависит от константы диссоциации кислоты или основания и от соотношения концентраций компонентов буферных смесей.
Анализ этого уравнения показывает, что рН крови 7,4 по бикарбонатному буферу возможно при соотношении бикарбонатов (NaHCО3) и угольной кислоты (Н2СО3) равном 20. Такое соотношение и соблюдается в крови человека. Так как расчетное значение рН крови по бикарбонатному буферу (7,39) совпадает с экспериментальным (7,4), то, следовательно, величина рН крови может определяться, в основном, бикарбонатной буферной системой.
