
- •Предисловие
- •Введение
- •Роберт Вильгельм Бунзен
- •Анри Луи Ле Шаталье
- •Вильгельм Фридрих Оствальд
- •Сванте Август Аррениус
- •Якоб Генрих Вант-Гофф
- •Иоханн Николаус Брёнстед и Михаил Ильич Усанович
- •Николай Николаевич Семенов
- •Химическая термодинамика учебно-целевые задачи – научить студентов:
- •Значимость темы
- •Основные понятия и определения химической термодинамики
- •Внутренняя энергия
- •Теплота и работа
- •Первый закон термодинамики
- •Применение I закона к простейшим процессам
- •Тепловые эффекты. Закон гесса
- •Теплоемкость
- •Второй закон термодинамики
- •Некоторые формулировки 2-го закона
- •Изменение энтропии при различных процессах
- •Пастулат планка
- •Термодинамические потенциалы
- •Соотношение между термодинамическими потенциалами
- •Закон действующих масс
- •Вопросы по теме: "термодинамика"
- •Примеры решения типовых задач
- •Пример решения контрольного задания по теме "Термодинамика"
- •Решение
- •Задачи для самостоятельной работы
- •Варианты заданий для домашней контрольной работы
- •Лабораторная работа №1.
- •Особые условия выполнения работы:
- •Устройство и настройка термометра Бекмана
- •Термодинамика фазовых превращений
- •Термодинамика фазовых равновесий
- •Основные понятия
- •Уравнение клайперона-клаузиуса
- •Диаграммы состояния однокомпонентных систем
- •Диаграмма состояния воды
- •Диаграмма состояния диоксида углерода
- •Бинарные системы Диаграммы плавкости
- •Взаимная растворимость жидкостей
- •Трехкомпонентные системы
- •Равновесие жидкость-жидкость в трехкомпонентных системах.
- •Распределение растворяемого вещества между двумя жидкими фазами. Экстракция.
- •Вопросы для подготовки к занятиям по теме: "термодинамика фазовых равновесий".
- •Примеры решения типовых задач.
- •Задачи для самостоятельной работы.
- •Лабораторная работа 1: построение диаграммы плавкости 2-х компонентной системы с простой эвтектикой.
- •Лабораторная работа № 2. Изучение взаимной растворимости фенола и воды.
- •Лабораторная работа № 3. Определение коэффициента распределения уксусной кислоты между водой и бензолом.
- •Свойства разбавленных растворов электролитов и неэлектролитов.
- •Повышение температуры кипения растворов.
- •Понижение температуру замерзания растворов.
- •Биологическое значение осмотического давления
- •Указания к выполнению работы.
- •Вопросы для самоконтроля по технике выполнения работы
- •Вопросы для самоконтроля при выполнении данного задания
- •Вопросы и задачи для самоконтроля усвоения темы
- •Вопросы для самоконтроля усвоения материала практической работы
- •Биологический статус изучаемой темы
- •Вопросы для подготовки:
- •Диссоциация воды
- •Водородный показатель
- •Механизм действия буферных систем
- •РН буферных систем
- •Влияние изменения объема буферных систем на рН.
- •Кислотно-щелочное равновесие крови
- •Роль внутренних органов в поддержании кислотно-щелочного резерва.
- •Изменение кислотно-щелочного равновесия при различных заболеваниях.
- •Задачи и задания для самостоятельной работы
- •Экспериментальная часть
- •Работа №3. Определение буферной ёмкости.
- •Электрохимия. Учебно-целевые задачи: Изучив этот раздел учебной программы, студент должен знать:
- •Значение электрохимических явлений для медицины.
- •Электродные процессы и электродвижущие силы.
- •Электрод и электродный потенциал.
- •Строение двойного электрического слоя на границе раствор-металл
- •Уравнение нернста
- •Гальванические элементы и их электродвижущие силы
- •Концентрационные гальванические элементы.
- •Диффузный потенциал.
- •Электроды первого рода.
- •Водородный электрод.
- •Ионоселективные электроды
- •Стеклянный электрод
- •Электроды второго рода.
- •Хлорсеребряный электрод Аg ׀ Ag Cl. KCl
- •Сопровождается реакцией растворения или осаждения соли АgСl:
- •Окислительно – восстановительные системы (ов) и ов –электроды.
- •Уравнение Петерса.
- •Классификация обратимых электродов.
- •Измерение эдс гальванических элементов.
- •Потенциометрия.
- •Прямые потенциометрические методы.
- •Приложение
- •Экспериментальная часть. Лабораторная работа №1. Измерение эдс гальванических элементов.
- •Порядок выполнения работы.
- •Изменение потенциалов отдельных электродов.
- •Потенциалов отдельных электродов.
- •Лабораторная работа № 3.
- •Лабораторная работа №4. Потенциометрическое измерение окислительно – восстановительных потенциалов. Редокс – системы.
- •Кинетика
- •Значение для медицины и фармации
- •Вопросы для подготовки к занятию
- •Введение
- •Понятие о скорости химического процесса
- •Основной закон химической кинетики
- •Кинетические уравнения реакций
- •Реакции первого порядка
- •Реакции второго порядка
- •Сложные реакции
- •Гетерогенные реакции
- •Температурная зависимость константы скорости реакции.
- •Методы расчета энергии активации и предэкспоненциального множителя а.
- •Основы молекулярной кинетики
- •Теория активных столкновений
- •Теория переходного состояния
- •Задачи и задания для самостоятельного решения.
- •Экспериментальная часть
- •Опыт № 1.Зависимость от концентрации.
- •Опыт №2. Зависимость от температуры
- •Учебно-методическое и информационное обеспечение дисциплины
- •По технике безопасности
- •И производственной санитарии при работе
- •В химических лабораториях
- •Медицинских учебных заведений
- •Содержание
Задачи для самостоятельной работы.
1.Определите число степеней свободы для системы, в которой происходит следующая реакция:
Na2S04 + 2 KCI= K2S04 + 2 NaCl,
в системе присутствуют пары воды и кристаллы КС1.
Ответ: С=2.
2. Вычислите теплоту испарения диэтилового эфира, если при нормальной температуре кипения (307,9 К) dр/dт=3,53*103 Па/К.
Ответ: 2,74* 104 Дж/моль.
3. Найдите молярную теплоту плавления дифениламина, если плавление сопровождается увеличением объема, равным 95,8 см3 /кг.
Изменение температуры плавления при изменении давлении в точке плавления (54°С) равно 0,027 град/Па. Молярная масса дифениламина равна 169,2г/моль.
4. Вычислите теплоту испарения лекарственного вещества в интервале температур 88 - 112 К, если давление при этих температурах 8*103 и 101* 103Па.
Ответ: 8,64 кДж/моль.
5. Вычислите молярную теплоту испарения жидкости, если при давлении 760 мм.рт.ст. она кипит при 69°С, а при 571 мм.рт.ст. - при 60 С.
Ответ:________.
6. По приведенной диаграмме:
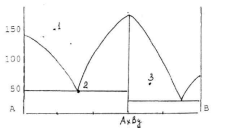
а) определите состав химического соединения и расставьте фазы на фазовых полях.
б) определите составы и температуры плавления эвтектических сплавов.
в) нарисуйте кривую охлаждения смеси, содержащей 50% В и сделайте вывод о фазовых превращениях, происходящих в системе, укажите их температуры.
г) для сплава состава точки 3 рассчитайте количества равновесных фаз, учитывая, что масса всего сплава равна 1 кг.
д) определите состав жидкой фазы сплава в точке 3.
7. По приведенной диаграмме:
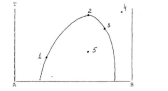
а) расставьте фазы на фазовых полях;
б) из отмеченных на диаграмме точек выберите критическую точку и точку, находящуюся в гомогенной области;
в) определите вариантность системы, в точках (1,4,5).
г) для точки 5 определите общий состав смеси и равновесных фаз, а так же их количество, если масса смеси равна 0,5 кг.
8. Сколько нужно провести экстракций, чтобы извлечь, йод на 99% из 4дм3 водного раствора концентрацией 0,1 г/дм3, если йод экстрагируется порциями сероуглерода по 100 мл. Величина Кд=59.
Ответ: 2 экстракции.
9. Сколько воды потребуется для извлечения уксусной кислоты из 500 мл 0,1М ее раствора в амиловом спирте, если ее концентрация в водном растворе должна быть доведена до 0,05 моль/л? Коэффициент распределения уксусной кислоты между амиловым спиртом и водой равен 0,914.
10. В бензоле пикриновая кислота находится в виде одинарных молекул С6Н2(NO2)3ОН и не диссоциирует на ионы. Равновесные концентрации С в водном и бензольном слое (моль/л):
|
Водный слой (с× 103) |
2.08 |
3.27 |
7.01 |
10.1 |
|
Бензольный слой (с×103) |
0.932 |
2.25. |
10.1 |
19.9 |
Рассчитать К и показать, что, растворяясь в воде, пикриновая кислота диссоциирует на ионы.
Ответ:
Лабораторная работа 1: построение диаграммы плавкости 2-х компонентной системы с простой эвтектикой.
ЦЕЛЬ РАБОТЫ:
Снять кривые охлаждения чистых компонентов и их смесей.
По кривым охлаждения построить диаграмму плавкости системы в координатах температура - состав.
НЕОБХОДИМЫЕ РЕАКТИВЫ И ОБОРУДОВАНИЕ.
Изучаемые вещества (по выбору преподавателя), Сухие пробирки, пробки с отверстиями для мешалки и термометра, термометр на 150-200 С. водяная или масляная баня, мешалки.
ПОСЛЕДОВАТЕЛЬНОСТЬ ВЫПОЛНЕНИЯ РАБОТЫ.
В несколько пробирок насыпают чистые вещества и их смеси (число и состав смесей указывается преподавателем). Масса каждой смеси должна быть равна 5 г. Каждую пробирку закрывают пробкой, в отверстия которой вставлен термометр со шкалой на 150-200°С и мешалка, затем пробирки по одной помещают в водяную или масляную баню, нагретую до необходимой температуры. После того, как содержимое пробирки расплавится и несколько перегреется, пробирку со смесью переносят в другую, более широкую пробирку (воздушная рубашка), и через каждые 15-30 сек (по секундомеру) записывают показания термометра. Измерение ведут при непрерывном перемешивании охлаждаемого вещества. После появления первых кристаллов перемешивание прекращают.
Для чистых веществ наблюдение за температурой прекращают после температурной остановки. Для смесей наблюдение прекращают после отвердевания эвтектики (во всех случаях рекомендуется после застывания всей массы произвести отсчет температуры еще 3-4 раза). Результаты измерения температуры записывают в таблицу.
|
Время от начала опыта, мин |
Температура cмеси, 0С | ||||||
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
|
|
|
|
|
|
|
|
На основании полученных данных строят кривые охлаждения, по которым определяют температуру начала кристаллизации, эвтектическую температуру. Эти результаты вместе с данными о составе, выраженными в весовых процентах записываются в таблицу.
|
Номер смеси |
Состав смеси в % |
Температура начала кристаллизации |
Температура отвердевания эвтектики,°С | |
|
А |
В | |||
|
|
|
|
|
|
|
|
|
|
|
|
По полученным результатам строят диаграмму плоскости в координатах температура - состав.
