
chemistry / chemistry1 / ХимиЯ / 132-133
.doc


И
CH3OH
сич он
Рис. 5.2. Переход системы из более упорядоченного состояния к менее упорядоченному
С
 остояние
системы можно характеризовать
микросостояниями составляющих
ее частиц, т.е. их мгновенными координатами
и скоростями различных видов движения
в различных направлениях. Число
микросостояний системы называется
термодинамической
вероятностью
системы
W.
Так
как число частиц в системе огромно
(например, в 1 моль имеется 6,02 ■ 1023
частиц),
то термодинамическая вероятность
системы выражается огромными
числами. Поэтому пользуются логарифмом
термодинамической
вероятности In
W.
Величина,
равная IunW=
S,
называется
энтропией
системы,
отнесенной к одному молю вещества.
Как и универсальная газовая постоянная
R,
энтропия
имеет единицу измерения ДжДмоль • К).
Энтропия вещества в стандартном
состоянии называется стандартной
энтропией
5°. В справочниках обычно приводится
стандартная энтропия 5°298 при 298,15 К (см.
приложение 2).
остояние
системы можно характеризовать
микросостояниями составляющих
ее частиц, т.е. их мгновенными координатами
и скоростями различных видов движения
в различных направлениях. Число
микросостояний системы называется
термодинамической
вероятностью
системы
W.
Так
как число частиц в системе огромно
(например, в 1 моль имеется 6,02 ■ 1023
частиц),
то термодинамическая вероятность
системы выражается огромными
числами. Поэтому пользуются логарифмом
термодинамической
вероятности In
W.
Величина,
равная IunW=
S,
называется
энтропией
системы,
отнесенной к одному молю вещества.
Как и универсальная газовая постоянная
R,
энтропия
имеет единицу измерения ДжДмоль • К).
Энтропия вещества в стандартном
состоянии называется стандартной
энтропией
5°. В справочниках обычно приводится
стандартная энтропия 5°298 при 298,15 К (см.
приложение 2).
В отличие от других термодинамических функций, можно определить не только изменение, но и абсолютное значение энтропии. Это вытекает из высказанного в 1911 г. М. Планком постулата, согласно которому «при абсолютном нуле энтропия идеального кристалла равна нулю». Этот постулат получил название третьего закона термодинамики.
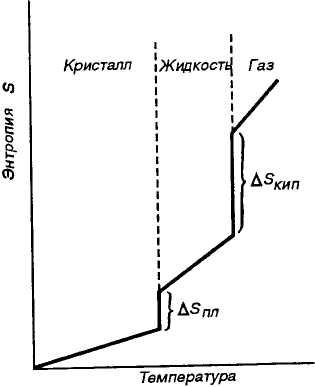
По мере повышения температуры растет скорость различных видов движений частиц, т.е. число их микросостояний и соответственно термодинамическая вероятность и энтропия вещества (рис. 5.3). При пере- ходе вещества из твердого со-
Р и с. 5.3. Изменение энтропии вещества с СТОЯНИЯ В ЖИДКОе Значительно увеличением температуры увеличивается НеуПОрЯДОЧеН-
132
[узость и соответственно энтропия вещества (Д-Ущ,). Особенно резко {растет неупорядоченность и соответственно энтропия вещества |при его переходе из жидкого в газообразное состояние (Д&ип) (рис. |5.3). Энтропия увеличивается при превращении вещества из кри-§еталлического в аморфное состояние. Энтропия простых веществ уделяется периодической функцией порядкового номера элемента Щрл. рис. 11.4). Увеличение числа атомов в молекуле и усложнение шолекул приводит к увеличению энтропии. Например, р°298(О) = 161, S°298(O2) = 205, 5°298(О3) = 238,8 ДжДмоль • К). I Следует обратить внимание на то, что известны абсолютные |'значения энтропии многих веществ (см. приложение 2). | Изменение энтропии системы в результате протекания химической реакции (AS) равно сумме энтропии продуктов реакции за |вычетом энтропии исходных веществ с учетом стехиометрических Цкоэффициентов. Изменение энтропии системы в результате проте-Цкания химической реакции:
dD + ЬВ = /L + /иМ
fравно
mSu-dSD-bSB.
Например, изменение энтропии в ходе реакции СН4 + Н2О(г) = СО + ЗН2
„.ри стандартных состояниях реагентов и продуктов процесса и Й98 К на моль СИ» равно:
I = 197,54 + 3 • 130,58 -
- 186,19 - 188,7 = 214,39 ДжДмоль • К).
Как видно, энтропия системы в результате реакции возросла iS > 0. Так как энтропия вещества в газообразном состоянии су-дественно выше, чем в жидком и твердом состояниях, то измене-[ие энтропии положительно, если в результате процесса возрастает шсло молей газообразных веществ, как в только что рассмотренном примере. Вследствие высоких значений энтропии газов, по-|Следние называют «носителями энтропии».
)' Итак, энтропия характеризует число микросостояний, является ^Мерой беспорядка в системе. Ее увеличение говорит о переходе ристемы из более упорядоченного состояния к менее упорядоченному в результате тех или иных, в том числе химических, процес-
133
