
chemistry / chemistry1 / ХимиЯ / ГальваническийЭлемент
.docГальванический элемент- это устройство в котором за счет протекания окислительно-востанови. химич. реакции совершается электрическая работа.
Г.Э. состоит из двухэлектродов, к-я отличается значением равновесных потенциалов.
Принцип работы : обычно металл погружается в раствор, содержащий ионы этого же металла. Растворы отделяются друг от друга мембраной(полупроницаемой).
cu zn



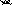


Cu2++so42- Zn2++so42-
Условная схема гальванич. элемента:
Zn|Zn2+||Cu2+|Cu
A: Zn – 2 e ->Zn2+ -ок-е
K: Cu2++2 e ->Cu –вост-е
Zn+Cu2+->Zn2++Cu (ион)
Zu+CuSO4->ZnSO4+Cu (молек)
Водородный электрод.
Относится к типу газовых электродов.
2H++2e->H2
φpH2|2H+=φ0 H2|2H++0.059/2*lg[H+]2/PH2=-0.059pH-0.0295lgPH2 –формула для расчета равновесия потенцыалов.
Вычисление ЭДС гальван. элем.
Работоспособность Г.Э. определяется его ЭДС (Е)
Е=φрк –φра .
Концентрационные элементы.
Г.Э. состоит из электродов одного вида, но отличающиеся концентрацией растворов электролитов наз-ся концентрационным.
(1) Сd|Cd2+||Cd2+|Cd (2)
(1) φpCd|Cd2+=φ0 Cd|Cd2++0.059/2*lg[Cd2+]=0.4-0.059=0.459 (B)
(2) φpCd2+|Cd=-0.4+0.059/2*lg10-4=-0.518 (B)
E= φрк –φра =-0.459+0.518=0.059 (B)
A: Cd – 2 e ->Cd2+ -ок-е
K: Cd2++2 e ->Cd –вост-е
Применение гальванического элемента.
Используется как источник постоянного электрического тока. Г.Э. бывает одноразового
Пользования (сухие элементы), многократного действия (аккумуляторы).
Электрохимич. Проч.
Электродный потенциал – разность потенциалов, возникающ. м/у металлом и окруж. Его жидкой средой. Для водный растворов –(Н) электрод, потенциал=0.





















 Кресталич.
решетка- струк.
Кресталич.
решетка- струк.
В узлах которой находится
Катионы Ме заряд их
Компенсирует элуктрон.
Внешнего уровня, кот.
Ме закрепленены за каждым конкретным атомом При погружение Ме действ. 2е силы. Ек- крестал. решетки (катионы удерж. Вструктуре Ме ) Ег – взаимодействие положит. Молек. Н2О с катионами Ме на пов. Пластины; катионы Ме стрем. перейти в раствор электролита с пов. Пластины => гидротир.сост.

 -
Zn ZnSO4
-
Zn ZnSO4
-
- Zn+mH2O->Zn2++mH2O
- EK<EГ
-на повер. Ме возникает откр. Эл. Заряд , за счет не скомпенсирован. Элект.
-вдоль “-” выстраиваются”+”
-процесс будет идти пока не установится равновес.
-по мере удаления от пластины слой будет размыватся.
-φрZn|Zn2+<0 –равновесие электр.
EK> EГ = СuSO4 .
