
chemistry / chemistry1 / ХимиЯ / 288-289
.docji ■ i
i 1
где В, — выход по токуу-го вещества; Q; — количество электричества, израсходованное на превращение j-ro вещества; Q — общее количество электричества, прошедшее через электрод.
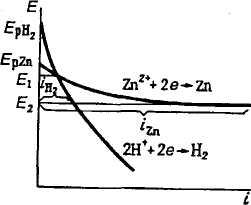
Из рис. 9.11 следует, что выход по току цинка растет с увеличением катодной поляризации. Для данного примера высокое водородное перенапряжение — явление положительное.
Из водных растворов удается выделять на катоде марганец, цинк, хром, железо, кадмий, кобальт, никель, олово и другие металлы.
На аноде протекают реакции окисления восстановителей, т. е. отдача электронов восстановителем, поэтому в первую очередь на аноде должны реагировать наиболее сильные восстановители — вещества, имеющие наиболее отрицательный потенциал. На аноде при электролизе водных растворов может протекать несколько процессов:
а) растворение металла
М — пе —» М"+
б) окисление ионов ОН"
2ОН" - 2е -> '/2О2 + Н2О
в) окисление других веществ, присутствующих в растворе или около электрода,
Red — пе -> Ох
Если потенциал металлического анода имеет более отрицательное значение, чем потенциал окисления ионов ОН~ или других веществ, присутствующих в растворе, в газовой фазе около электрода или на электроде, то происходит растворение металла. При этом протекает электролиз с растворимым анодом. Если потенциал металлического анода близок к потенциалу других электродных процессов, то наряду с растворением металла на аноде протекают также другие процессы, например, разряд ионов ОН". В этом случае также говорят об электролизе с растворимым анодом, но учитывают и другие анодные процессы. Если потенциал металла или другого проводника первого рода, используемого в качестве анода, имеет более положительное значение, то протекает электролиз с нерастворимым анодом. В качестве нерастворимых анодов применяют золото и платиновые металлы, диоксид свинца, оксид рутения и другие вещества, имеющие положитель-
288
,ie значения равновесных электродных потенциалов, а также афит. Некоторые металлы практически не растворяются из-за пассивации, вызывающей высокую анодную поляризацию, на-ример, никель и железо в щелочном растворе, свинец в H2SO4, |*итан, тантал, нержавеющая сталь. Явление торможения анодного астворения металла из-за образования защитных слоев называется ассивностью металла (см. § 10.3).
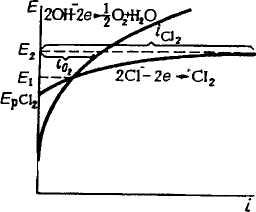
При электролизе с нерастворимым анодом на электроде может |окисляться или ион ОН", или другие ионы, или недиссоцииро-^ванные молекулы восстановителей, присутствующие в растворе, видно из рис. 9.6, потенциал кислородного электрода в ши-жой области рН отрицательнее потенциалов галогенидных ио-щов (за исключением иона Г), однако при наличии в растворе ио-яов галогенов вследствие высокой поляризации реакции выделе-ля кислорода в первую очередь на аноде выделяется иод, за-|тем — бром. При наличии ионов СП в растворе при малых плотностях тока идет выделение кислорода, при высоких плотностях жа наряду с этой реакцией идет также окисление ионов СГ и выделение СЬ (рис. 9.12). Фтор из-за положительного значения ^потенциала не может быть вьщелен из водных растворов на аноде, его получают электролизом расплавленных фторидов. На аноде не окисляются также ионы SO^, РО*", NOJ, поэтому в их присутст-1и в растворе на нерастворимом аноде протекает лишь реакция лделения кислорода*.
Еро,
Рис. 9.11. Поляризационные кривые катодного выделения водорода и цинка
Рис. 9.12. Поляризационные кривые анодного выделения кислорода и хлора
Ионы SO2,' могут окислять до S2Og" при высоком анодном потенциале (см. ■4>иложение 7), который обычно не достигается.
- 3287
289
Рассмотрим электролиз с нерастворимым анодом водных рас-атворов солей Na2SO4 и NaCl:
