
chemistry / chemistry1 / ХимиЯ / 284-285
.doc'li
Задачи для самоконтроля
9.16. Токсичные ионы свинца можно удалить из сточных вод катодным восста новлением
РЬ1* + 2е -> РЬ
Рассчитайте максимальную скорость выделения свинца на катоде (предельную плотность тока) из раствора, содержащего 2,07 г/л РЬ2+, принимая коэффициент диффузии ионов РЬ2+ равным 10"9 м2/с и толщину диффузионного слоя 10"4 м. Определите концентрационную поляризацию при 298 К и плотности тока 9 А/м2. Определите массу свинца, который выделится на катоде площадью 0,5 м2 при этой плотности тока за 10 ч.
9.17. Определите ток, идущий на выделение водорода на платине и свинце пло щадью по 1 м2 из щелочных растворов при поляризации электродов 0,5 В, учитывая константы (см. табл. 9.1). Определите объем выделившегося водорода за 1 час на этих электродах при нормальных условиях.
§ 9.6. ЭЛЕКТРОЛИЗ
Общие понятия. Электролизом называют процессы, происходящие на электродах под действием электрического тока, подаваемого от внешнего источника. При электролизе происходит превращение электрической энергии в химическую. Ячейка для электролиза, называемая электролизером, состоит из двух электродов и электролита. Электрод, на котором идет реакция восстановления (катод), у электролизера подключен к отрицательному полюсу внешнего источника тока. Электрод, на котором протекает реакция окисления (а н о д), подключен к положительному полюсу источника тока.
Рассмотрим электродные реакции на примере электролиза расплава хлорида натрия*. При плавлении происходит термохимическая диссоциация соли:
NaCl -> Na+ + СГ
Если погрузить в расплавленную соль два нерастворимых электрода и подключить их к полюсам внешнего источника тока, то в электролите начнется направленное движение ионов и на электродах будут протекать следующие реакции:
а) восстановление ионов Na+ до металлического натрия (катодный процесс) на отрицательном электроде, т.е. электроде, на который поступают электроны от внешнего источника тока:
* Для
снижения температуры плавления
электролита и растворимости натрия в
электролит
вводят хлорид кальция или хлорид калия
и фторид натрия.
Для
снижения температуры плавления
электролита и растворимости натрия в
электролит
вводят хлорид кальция или хлорид калия
и фторид натрия.
284
Na+ + e -> Na
б) окисление хлорид-ионов СГ до газообразного хлора (анод-* ный процесс) на положительном электроде, с которого электроны идут во внешнюю цепь:
Суммарная реакция
NaCl -> Na + '/2С12
Электролиз подчиняется законам Фарадея и уравнениям кинетики электродных процессов. При прохождении тока изменяются потенциалы электродов электролизера, т.е. возникает электродная поляризация. Вследствие катодной поляризации потенциал катода становится более отрицательным, а из-за анодной поляризации потенциал анода становится более положительным (рис. 9.10). Поэтому разность потенциалов электродов при прохождении тока Ei = Eia — Еь при электролизе больше, чем разность равновесных потенциалов электродов Е, = Ер.3 — Ер,к.
Напряжение электролизера слагается из разности равновесных потенциалов Еу (ЭДС), поляризации анода и катода АЕ и падения напряжения в проводниках 1-го и 2-го рода 1{г\ + г2):
(П + гХ (9.21)
где АЕ=АЕК + АЕЛ.
9.10. Поляризация
Т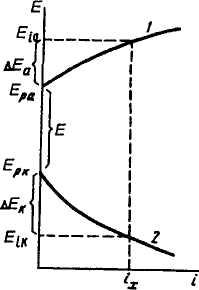 аким
образом, напряжение электролизера
с увеличением тока возрастает вследствие
поляризации и сопротивления
проводников и электролита. Увеличение
напряжения по сравнению с ЭДС приводит
к перерасходу электрической энергии
по сравнению с энергией, рассчитанной
по уравнениям химической термодинамики.
Из уравнения (9.21) следует,
что напряжение может быть снижено
уменьшением сопротивления электродов
и электролита, а также поляризации
электродов. Внутреннее сопротивление
электролизера можно снизить „
аким
образом, напряжение электролизера
с увеличением тока возрастает вследствие
поляризации и сопротивления
проводников и электролита. Увеличение
напряжения по сравнению с ЭДС приводит
к перерасходу электрической энергии
по сравнению с энергией, рассчитанной
по уравнениям химической термодинамики.
Из уравнения (9.21) следует,
что напряжение может быть снижено
уменьшением сопротивления электродов
и электролита, а также поляризации
электродов. Внутреннее сопротивление
электролизера можно снизить „
Применением Электролита С ВЫСОКОЙ анода (I) и катода (2) при
Удельной электрической проводимостью, электролизе
285
г И С.
