
chemistry / chemistry1 / ХимиЯ / 298-299
.doc1 I 111
Р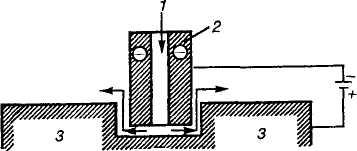 ис.
9.13. Схема электрохимической
обработки металлов:
ис.
9.13. Схема электрохимической
обработки металлов:
/ — раствор электролита; 2 — катод (инструмент); J—анод (изделие)
ф
тельному полюсу источника тока подключается катод (инструмент), обычно изготавливаемый из стали. На катоде выделяется водород. Между электродами сохраняется небольшой зазор, по мере растворения анода передвигают катод, чтобы сохранить малое расстояние между анодом и катодом. В зазор между электродами подается под давлением раствор электролита, в данной установке через полость в центре катода. Раствор электролита выносит из межэлектродного пространства продукты анодного растворения и газообразные продукты катодной реакции. Последние затем удаляются в атмосферу, а продукты растворения тем или иным сдособом выводятся из раствора электролита. В качестве растворов электролитов для обработки сталей и многих цветных металлов (никель, медь, кобальт, титан) и их сплавов применяется раствор NaCl; для обработки алюминия, цинка, олова и их сплавов — раствор NaNO3, для обработки молибдена и вольфрама — раствор NaOH.
В настоящее время ЭХОМ используется для обработки лопаток турбин, штампов и пресс-форм, твердых и тугоплавких металлов и сплавов, получения и обработки отверстий и полостей, для фрезерования, точения и шлифования различных изделий, заточки инструмента.
Анодное оксидирование (анодирование) широко применяется для обработки металлов и прежде всего алюминия. Алюминиевое изделие играет роль анода электролизера. Электролитом служит раствор серной, ортофосфорной, хромовой, борной или щавелевой кислот, катодом может быть металл или сплав, не взаимодействующий с раствором электролита, например нержавеющая сталь или свинец. На катоде выделяется водород, на аноде происходит образование оксида алюминия AI2O3. Суммарный процесс на аноде можно представить следующим уравнением:
• А12О3
6Н+
2А1 + ЗШЭ — бе
Механизм реакции имеет сложный характер. Электродная реакция протекает в несколько стадий. Наряду с образованием оксида происходит его частичное растворение в кислоте: 298
ЗН2О
А12О3 + 6Н+ = 2А13
В результате пленка становится пористой, через поры пленки эникают ионы и процесс роста пленки продолжается. Получен-пленка АЬОз имеет ценные свойства. Она весьма пориста, при-бм размеры пор очень малы. Вследствие этого пленка может быть ропитана различными составами, повышающими коррозионную эйкость поверхности. Красители также могут придать поверхно-разнообразную окраску, что используется при декоративной бработке алюминия и его сплавов.
Оксидная пленка на алюминии имеет высокую твердость, поэму после анодирования и пропитки оксидного слоя смазкой рачительно повышается износостойкость деталей. В растворах эрной, щавелевой и лимонной кислот получаются тонкие плотве пленки с высоким электросопротивлением, например на алю-линии высокой чистоты — пленки с электросопротивлением 1014 )м • см. Поэтому оксидирование используется для получения изо-фующих слоев на лентах, применяемых в электрических конден-аторах и других устройствах.
Кроме алюминия производят также электрохимическое оксиди-эвание магния, меди и титана, например, по реакции
2Н+ + 2е
Mg + 2Н2О -> Mg(OH)2
Электролиз нашел применение в различных отраслях в технике, ричем области его использования непрерывно расширяются. На-ример, в последние годы разработаны электрохимические преоб-азователи информации и электрохромные устройства, в основе действия которых лежат законы электролиза.
Вопросы и задачи для самоконтроля
9.20. На электролитическое рафинирование в водных растворах H2SO4 поступи ла медь, содержащая примеси цинка и серебра. Какие процессы будут протекать на >аноде и катоде? Где окажутся в результате рафинированные серебро, медь и цинк?
_^Какое время нужно для проведения электролиза при токе 100 А, чтобы на катоде
доездилась медь массой 1,37 кг при ВСи = 100 %?
9.21. Электрохимическое хромирование проводят из раствора хромовой ^(H2CrO.i) и серной кислот. Какие процессы протекают на нерастворимом аноде и
Катоде? Рассчитайте время, необходимое для получения хромового покрытия тол-% Щиной 20 мкм при плотности тока 1 кА/м2, выходе хрома по току 30 % и плотности \ Хрома 7,14 г/см3. Рассчитайте объемы газов при нормальных условиях, выделивших-■ Ся на аноде и катоде на единице площади электродов (1 м2) за это время. '< 9.22. Сколько времени необходимо для электрохимического фрезерования в никеле канавки длиной 10 см, шириной 1 см и глубиной 0,1 см при токе 100 А и выходе по току 50 %? Плотность никеля 8,9 г/см3.
299
