
chemistry / chemistry1 / ХимиЯ / 272-273
.doc


 Стандартные
потенциалы металлических электродов
в воднЬ1х
растворах
приведены в приложении 6, которое является
одновременно
и рядом стандартных электродных
потенциалов. Стандарт, ные
электродные потенциалы металлов
указывают на меру окислительно-восстановительной
способности металла и его ионов Чем
более отрицательное значение имеет
потенциал металла, тем более
сильной восстановительной способностью
он обладает. Например, литий, имеющий
наиболее отрицательный стандартный
потенциал, относится к наиболее сильным
восстановителям. Ц наоборот,
чем более положителен потенциал
металлического электрода,
тем более сильной окислительной
способностью обладают его ионы. Из
приложения 6 видно, что к наиболее сильным
окислителям
принадлежат ионы золота, платины,
палладия, серебра
и ртути.
Стандартные
потенциалы металлических электродов
в воднЬ1х
растворах
приведены в приложении 6, которое является
одновременно
и рядом стандартных электродных
потенциалов. Стандарт, ные
электродные потенциалы металлов
указывают на меру окислительно-восстановительной
способности металла и его ионов Чем
более отрицательное значение имеет
потенциал металла, тем более
сильной восстановительной способностью
он обладает. Например, литий, имеющий
наиболее отрицательный стандартный
потенциал, относится к наиболее сильным
восстановителям. Ц наоборот,
чем более положителен потенциал
металлического электрода,
тем более сильной окислительной
способностью обладают его ионы. Из
приложения 6 видно, что к наиболее сильным
окислителям
принадлежат ионы золота, платины,
палладия, серебра
и ртути.
Потенциалы газовых электродов. Газовые электроды состоят из проводника 1 -го рода, контактирующего одновременно с газом и раствором, содержащим ионы этого газа. Проводник 1-го рода служит для подвода и отвода электронов и, кроме того, является катализатором электродной реакции (ускоряет установление равновесия на электроде). Проводник 1-го рода не должен посылать в раствор собственные ионы. Лучше всего удовлетворяют этому условию платина и платиновые металлы, поэтому они чаще всего используются при создании газовых электродов.
Так как в равновесных электродных реакциях газовых электродов участвуют газообразные компоненты, то электродные потенциалы этих электродов зависят от парциальных давлений газов. Это
л-ол
-0,8 го электрода. Оно имеет вид:
S 78 10 12 рН
м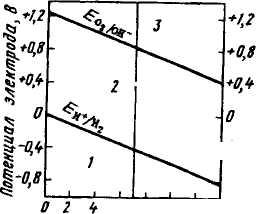 ожно
показать на примерах водородного и
кислородного электродов. Равновесие
на водородном электроде выражается
уравнением 2Н+
+ Ъе
*± Нг-Уравнение
для расчета потенциала водородного
электрода можно вывести так
же, как было выведено уравнение для
расчета потенциала металлическо-
ожно
показать на примерах водородного и
кислородного электродов. Равновесие
на водородном электроде выражается
уравнением 2Н+
+ Ъе
*± Нг-Уравнение
для расчета потенциала водородного
электрода можно вывести так
же, как было выведено уравнение для
расчета потенциала металлическо-
RT, <
= 1п-
2F
Рис. 9.6. Зависимости потенциалов водородного и кислородного^ электродов от рН среды при реи =/>н2 =1 (100 кПа)
272
н*/н2
или для 298 К
(9.Па)
(9.116)
а . — активность ионов Н+ в электролите; рНг — относительное рциальное давление водорода. Учитывая, что lgaHt = - рН, получаем при 298 К
1 Потенциал водородного электрода принимает более отрицательное значение с увеличением давления водорода и рН. Зависимость потенциала водородного электрода от рН раствора приведена рис. 9.6.
Аналогично водородному электроду можно создать кислород-электрод. Для этого проводник 1-го рода, например Pt, необ-димо привести в контакт с кислородом и раствором, содержа-им ионы, которые образуются при восстановлении кислорода Ионы ОН):
О2, Pt | ОН' Если на кислородном электроде протекает реакция по уравне-
ию
О2 + 2Н2О + 4с выражение равновесного потенциала имеет вид для 298 К:
{ РогО
0,059
(9.12)
= F0 +
Так как активность воды в ходе реакции меняется мало, то ее считают величиной постоянной и значение ——lga^ 0 вводят в
Е
Oj/OH"
(9.13)
= </Oh-+0>01471S-
■*он-
2 / ОН
— стандартный потенциал кислородного электрода,
вный 0,401 В (при сон- = 1)-
Подставляя в уравнение (9.13) значение аон. =Кь/аи. и вн» = — рН, получаем
273
8 - 3287
