
- •Міністерство освіти і науки України
- •1 Програма з розділу «загальні основи аналітичної хімії»
- •Тема 1. 1 Предмет загальної, неорганічної та аналітичної хімії. Значення дисципліни для підготовки товарознавця. Найважливіші поняття та закони загальної хімії, які потрібні для вивчення курсу
- •Тема1.2 Періодичний закон та періодична система елементів
- •Тема 1.3 Сучасні теорії будови атомів та хімічного зв’язку як основа вивчення хіміко-аналітичних і фізичних властивостей сировини та матеріалів
- •Тема 1.4 Швидкість та механізм хімічних реакцій
- •Тема 1.5 Розчини та теорія електролітичної дисоціації
- •Тема 1.6 Рівновага у розчинах солей, які піддаються гідролізу
- •Тема 1.7 Рівновага у розчинах малорозчинних сполук
- •Тема 1.8 Рівновага у розчинах координаційних (комплексних) сполук
- •Тема 1.9 Рівновага при перебігу окисно-відновних реакцій (овр)
- •Тема 1.10 Систематичний аналіз катіонів та аніонів
- •Тема 1.11 Органічні аналітичні реагенти
- •Тема 1.12 Теорія та практика відбирання проби та її підготовка
- •Тема 1.13 Методи розподілу і концентрування
- •Тема 1.14 Об’ємний (титриметричний) аналіз
- •Тема 1.15 Гравіметричний (ваговий) аналіз
- •Студент повинен вміти:
- •Додаткова
- •Методичні матеріали
- •2 Приклади рішення типових задач. Питання та задачі до контрольних робіт
- •2.1 Приклади рішення типових задач з теми
- •2.2 Питання та задачі до контрольних робіт з теми
- •2.3. Приклади рішення типових задач з теми
- •2.4 Питання та задачі до контрольних робіт з теми
- •2.5 Приклади рішення типових задач з теми
- •2.6 Питання та задачі до контрольних робіт з теми
- •2.7 Приклади рішення типових задач з теми “Хімічний зв’язок”
- •2.8 Питання та задачі до контрольних робіт з теми “Хімічний зв’язок”
- •2.9 Приклади рішення типових задач з теми
- •2.10 Питання та задачі до контрольних робіт з теми
- •2.11 Приклади рішення типових задач з теми
- •2.12 Питання та задачі до контрольних робіт з теми
- •2.13 Приклади рішення типових задач з теми
- •2.14 Питання та задачі до контрольних робіт з теми
- •2.15 Приклади рішення типових задач з теми
- •2.16 Питання та задачі до контрольних робіт з теми
- •2.17 Приклади рішення типових задач з теми
- •2.18 Питання та задачі до контрольних робіт з теми
- •2.19 Приклади рішення типових задач з теми
- •2.20 Питання та задачі до контрольних робіт з теми
- •2.21 Приклади рішення типових задач з теми
- •2.22 Питання та задачі до контрольних робіт з теми
- •3. Варіанти контрольних робіт
2.4 Питання та задачі до контрольних робіт з теми
“Основні закони хімії”
21.
Під час прожарювання 20,4 г бертолетової
солі
![]() отримали калій хлорид та кисень. Треба
зазначити, що маса зменшилася на 8 г.
Розрахувати молекулярну масу: а) калій
хлориду; б) бертолетової солі.
отримали калій хлорид та кисень. Треба
зазначити, що маса зменшилася на 8 г.
Розрахувати молекулярну масу: а) калій
хлориду; б) бертолетової солі.
22. При нагріванні 65,1 г меркурій(ІІ) оксиду та 69,4 г аргентум(I) оксиду виділяються однакові кількості кисню, а саме 4,8 г. Розрахуйте: а) молекулярні маси обох оксидів; б) атомні маси аргентуму та меркурію?
23. Скільки ферум(ІІ) сульфіду можна отримати, якщо взяти для реакції 8 г сульфуру та 28 г заліза?
24. Хлоридна кислота, густина якої становить 1,145 г/см3, містить 29,2 % хлороводню. Скільки грамів хлороводню міститься в 1 л такої кислоти?
25.
Розрахувати об’єм, який займає 1 моль
нітрогену за н.у (![]() г/см3).
Чи відповідають одержаний результат
закону Авогадро?
г/см3).
Чи відповідають одержаний результат
закону Авогадро?
26.
Розрахувати об’єм, який займає 1 моль
метану за н.у (![]() г/см3).
Чи відповідають одержаний результат
закону Авогадро?
г/см3).
Чи відповідають одержаний результат
закону Авогадро?
27. Розрахувати об’єм, який
займає 1 моль гелію за н.у (![]() г/см3).
Чи відповідають одержаний результат
закону Авогадро?
г/см3).
Чи відповідають одержаний результат
закону Авогадро?
28. Густина газу за повітрям дорівнює 2. Якою є молекулярна маса газу?
Густина повітря за гелієм дорівнює 0,5. Якою є молекулярна маса газу?
Знайти густину газу за гідрогеном, якщо його густина за повітрям дорівнює 1,93.
31. Визначити густину за повітрям й масу 1 л пропану за нормальних умов.
32. Маса 500 мл газу за нормальних умов 1,806 г. Знайти його густину за повітрям та молекулярну масу.
33.Знайти об’ємний склад суміші карбон(II) оксиду та карбон(IV) оксиду, густина якої за воднем дорівнює 20,4.
34. Визначити об’ємний склад суміші кисню з карбону діоксидом, густина якої за воднем дорівнює 17,2.
35. Знайти об’ємний склад суміші карбон(II) оксиду та карбон(IV) оксиду, густина якої за воднем дорівнює 19,6.
36. Яка кількість газу міститься за нормальних умов в об’ємі 33,6 л ? Чому дорівнює маса диоксиду карбону, яка займає при нормальних умовах такий об’єм.
37. Якою є хімічна формула карбон оксиду, який має таку ж густину, як і нітроген?
Обчислити еквіваленти сульфатної кислоти в реакціях утворення:
а) сульфату; б) гідрогенсульфату.
39. Визначити еквівалент карбонатної кислоти в реакціях утворення карбонату та гідрогенкарбонату.
40. Обчислити еквівалент фосфатної кислоти в реакціях утворення:
а) ортофосфату, б) гідрогенфосфату, в) дигідрогенфосфату.
41. Написати рівняння реакцій алюміній гідроксиду з хлоридною кислотою, при яких утворюються наступні сполуки алюмінію: а) дигідроксохлорид; б) гідроксохлорид; в) трихлорид. Визначити еквівалент алюміній(III) гідроксиду в кожній з цих реакцій.
42. Написати рівняння реакцій бісмут(III) гідроксиду з хлоридною кислотою, при яких утворюються наступні сполуки: а) трихлорид, б) дигідроксохлорид, в) гідроксохлорид. Визначити еквівалент бісмут(III) гідроксиду в кожній з цих реакцій.
43. Чому дорівнює еквівалент бісмут(III) гідроксиду в реакції:
![]()
44.
Розрахуйте еквівалентні маси таких
сполук:
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() .
.
45.
Розрахуйте
еквівалентні маси таких сполук:
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() .
.
46.
Розрахуйте
еквівалентні маси таких сполук:
![]() ,
,
![]() ,
,
![]() ,
,
![]() .
.
47.
Розрахуйте
еквівалентні маси таких сполук:
![]() ,
,
![]() ,
,
![]() ,
,
![]() .
.
48.
Розрахуйте
еквівалентні маси таких сполук:
![]() ,
,
![]() ,
,
![]() ,
,
![]() .
.
49.
Розрахуйте
еквівалентні маси таких сполук:
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() .
.
50.
Розрахуйте
еквівалентні маси таких сполук:
![]() ,
,
![]() ,
,
![]() ,
,
![]() .
.
51.
Розрахуйте
еквівалентні маси таких сполук:
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() .
.
52.
Розрахуйте
еквівалентні маси таких сполук:
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() .
.
53.
Розрахуйте
еквівалентні маси таких сполук:
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() .
.
54.Визначити
еквівалент ![]() ,
з 1 г карбонату якого утворюється 1,71
г нітрату
,
з 1 г карбонату якого утворюється 1,71
г нітрату
![]() .
.
55.
Визначити еквівалент ![]() ,
1,4 г гідроксиду якого утворюють 4,15
г йодиду.
,
1,4 г гідроксиду якого утворюють 4,15
г йодиду.
56.
При взаємодії 5 г карбонату ![]() з нітратною кислотою утворилося 8,2 г
нітрату цього
з нітратною кислотою утворилося 8,2 г
нітрату цього ![]() .
Визначити еквівалент
.
Визначити еквівалент ![]() .
.
Визначити еквівалент
 ,
для відновлення 3,4
г оксиду
якого знадобилось стільки ж водню,
скільки виділилось під час реакції 6,5
г цинку з
кислотою.
,
для відновлення 3,4
г оксиду
якого знадобилось стільки ж водню,
скільки виділилось під час реакції 6,5
г цинку з
кислотою.Одна і та ж кількість
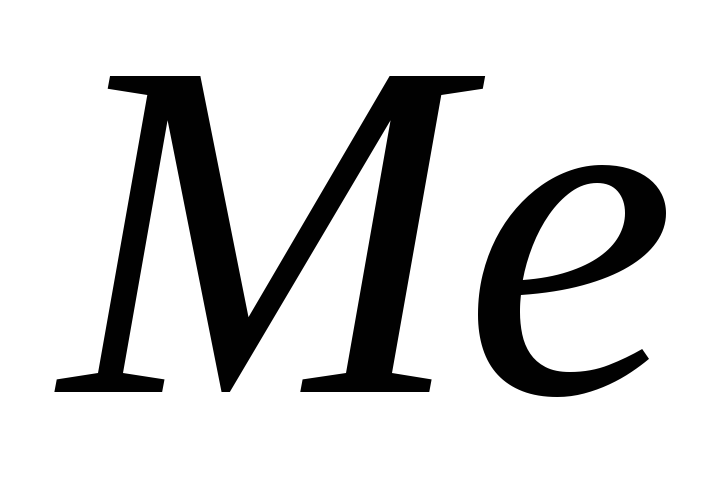 з’єднується з 0,4 г кисню та з 3,995 г
галогену. Який це галоген?
з’єднується з 0,4 г кисню та з 3,995 г
галогену. Який це галоген?
59.
При пропусканні сірководню крізь розчин,
який містить 5,21 г сульфату деякого ![]() ,
утворюється 3,61 г його сульфіду. Знайти
еквівалент
,
утворюється 3,61 г його сульфіду. Знайти
еквівалент ![]() .
.
60.
Сульфід ![]() вміщує 29,48 % сульфуру, визначити еквівалент
вміщує 29,48 % сульфуру, визначити еквівалент
![]() ,
якщо еквівалент сульфуру дорівнює 16.
,
якщо еквівалент сульфуру дорівнює 16.
