
- •Міністерство освіти і науки України
- •1 Програма з розділу «загальні основи аналітичної хімії»
- •Тема 1. 1 Предмет загальної, неорганічної та аналітичної хімії. Значення дисципліни для підготовки товарознавця. Найважливіші поняття та закони загальної хімії, які потрібні для вивчення курсу
- •Тема1.2 Періодичний закон та періодична система елементів
- •Тема 1.3 Сучасні теорії будови атомів та хімічного зв’язку як основа вивчення хіміко-аналітичних і фізичних властивостей сировини та матеріалів
- •Тема 1.4 Швидкість та механізм хімічних реакцій
- •Тема 1.5 Розчини та теорія електролітичної дисоціації
- •Тема 1.6 Рівновага у розчинах солей, які піддаються гідролізу
- •Тема 1.7 Рівновага у розчинах малорозчинних сполук
- •Тема 1.8 Рівновага у розчинах координаційних (комплексних) сполук
- •Тема 1.9 Рівновага при перебігу окисно-відновних реакцій (овр)
- •Тема 1.10 Систематичний аналіз катіонів та аніонів
- •Тема 1.11 Органічні аналітичні реагенти
- •Тема 1.12 Теорія та практика відбирання проби та її підготовка
- •Тема 1.13 Методи розподілу і концентрування
- •Тема 1.14 Об’ємний (титриметричний) аналіз
- •Тема 1.15 Гравіметричний (ваговий) аналіз
- •Студент повинен вміти:
- •Додаткова
- •Методичні матеріали
- •2 Приклади рішення типових задач. Питання та задачі до контрольних робіт
- •2.1 Приклади рішення типових задач з теми
- •2.2 Питання та задачі до контрольних робіт з теми
- •2.3. Приклади рішення типових задач з теми
- •2.4 Питання та задачі до контрольних робіт з теми
- •2.5 Приклади рішення типових задач з теми
- •2.6 Питання та задачі до контрольних робіт з теми
- •2.7 Приклади рішення типових задач з теми “Хімічний зв’язок”
- •2.8 Питання та задачі до контрольних робіт з теми “Хімічний зв’язок”
- •2.9 Приклади рішення типових задач з теми
- •2.10 Питання та задачі до контрольних робіт з теми
- •2.11 Приклади рішення типових задач з теми
- •2.12 Питання та задачі до контрольних робіт з теми
- •2.13 Приклади рішення типових задач з теми
- •2.14 Питання та задачі до контрольних робіт з теми
- •2.15 Приклади рішення типових задач з теми
- •2.16 Питання та задачі до контрольних робіт з теми
- •2.17 Приклади рішення типових задач з теми
- •2.18 Питання та задачі до контрольних робіт з теми
- •2.19 Приклади рішення типових задач з теми
- •2.20 Питання та задачі до контрольних робіт з теми
- •2.21 Приклади рішення типових задач з теми
- •2.22 Питання та задачі до контрольних робіт з теми
- •3. Варіанти контрольних робіт
2.11 Приклади рішення типових задач з теми
“Теорія електролітичної дисоціації”
Приклад
1. Якою є
молярність розчину сульфатної кислоти
з масовою часткою 15 % (![]()
![]() ?
?
Розв’язання: Молярна концентрація визначається кількістю молів розчиненої речовини в об’ємі розчину:
![]()
![]() .
.
Відомо, що масова частка сульфатної кислоти складає 15 %. Це означає, що у 100 г розчину міститься 15 г сульфатної кислоти.
![]()
де
![]()
маса
розчиненої речовини,
маса
розчиненої речовини,
![]() ;
;
![]() молекулярна
маса речовини,
молекулярна
маса речовини,
![]()
![]() =2132416=98
=2132416=98
![]()
![]() =
=![]() =0,15
=0,15
![]()
![]()
де
![]()
маса
розчину,
маса
розчину,
![]()
![]() густина
розчину,
густина
розчину,
![]()
![]()
![]() ,
,
![]()
![]()
Відповідь:
![]()
![]()
Приклад 2.Яку масу натрій хлориду необхідно розчинити в колбі на 200 мл, щоб одержати 0,2 н. розчин?
Розв’язання: Нормальність розчину (молярна концентрація еквіваленту) дорівнює відношенню кількості моль еквівалентів розчиненої речовини до об’єму розчину:
![]()
![]()
Кількість моль розчиненої речовини визначають за формулою:
![]()
де
![]()
маса
розчиненої речовини,
маса
розчиненої речовини,
![]() ,
,
![]() еквівалентна
маса речовини,
еквівалентна
маса речовини,
![]() .
.
Вираз
для нормальної концентрації можна
записати у вигляді:
![]() ,
,
![]() .
.
Еквівалент складної речовини можна розрахувати за формулою:
![]() ,
,
де
![]()
молекулярна маса речовини,
молекулярна маса речовини,
![]()
![]() кількість
атомів металу,
кількість
атомів металу,
![]() валентність
металу.
валентність
металу.
![]()
![]()
![]()
![]()
Відповідь:
![]()
![]()
Приклад
3. Розрахувати
![]() 0,1 н. розчину
0,1 н. розчину ![]() ,
якщо ступінь дисоціації складає 1 %.
,
якщо ступінь дисоціації складає 1 %.
Розв’язання: Дисоціацію амоніаку можна відобразити схемою:
![]()
Ступінь дисоціації дорівнює відношенню кількості молекул, що розпалися на іони до загальної кількості молекул, тобто
![]() %.
%.
Звідси
![]() ;
;
![]()
![]()
![]()
![]() ,
,
![]() .
.
Відповідь:
![]() .
.
2.12 Питання та задачі до контрольних робіт з теми
“Теорія електролітичної дисоціації”
121.Сформулюйте основні положення теорії електролітичної дисоціації.
122.Що таке ступінь дисоціації та константа дисоціації? Наведіть приклади сильних електролітів.
123.Що таке електроліт? Які з наведених сполук є сильними електролітами:
а)
![]() ;
б)
;
б)
![]() ;
в)
;
в)
![]() ;
г)
;
г)
![]() ;
д)
;
д)
![]() .
.
Напишіть рівняння реакцій дисоціації
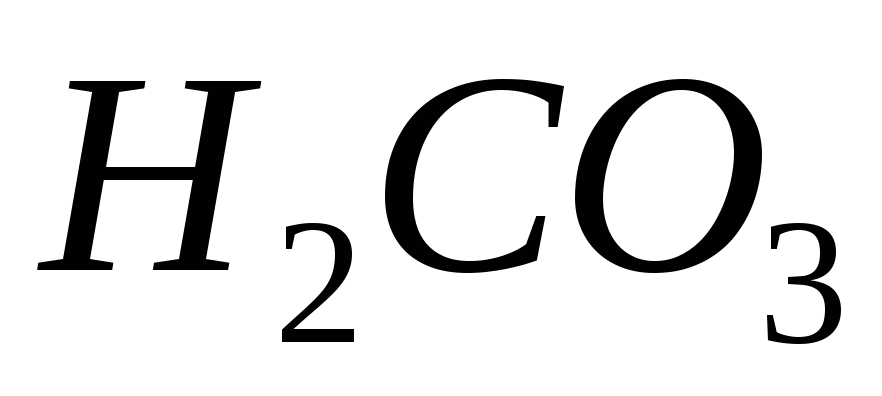 за двома ступенями та вирази відповідних
констант дисоціації.
за двома ступенями та вирази відповідних
констант дисоціації.Написати рівняння процесів електролітичної дисоціації, що відбуваються в розчинах наступних речовин:
 ,
,
 ,
,
 .
.Чи однакова концентрація гідроген-іонів в розчинах різних одноосновних кислот однакової молярної концентрації? Відповідь обґрунтуйте на прикладі двох кислот:
 та
та
 (Kд=510–8).
(Kд=510–8).Наведіть приклади буферних розчинів. Для чого їх використовують?
Написати рівняння процесів електролітичної дисоціації, що відбуваються в розчинах таких речовин:
 ,
,
 ,
,
 .
.
129. Скласти молекулярні рівняння реакцій:
![]()
![]() ;
;
![]() .
.
130.
Скласти
молекулярні та іонні рівняння реакцій,
які перебігають між речовинами
![]() та
та ![]() ,
,
![]() та
та ![]() ,
,
![]() та
та
![]() .
.
131. Скласти іонні та молекулярні рівняння розчинення купрум(ІІ) гідроксиду в розчині нітратної кислоти.
132. Скласти молекулярні рівняння реакцій, які виражаються іонними:
![]() ;
;
![]() ;
;
![]() .
.
133.
Cкладіть іонні та молекулярні рівняння
реакцій, які перебігають між речовинами
![]() та
та ![]() ,
,
![]() та
та ![]() ,
,
![]() та
та ![]() .
.
134.
До кожної
з речовин: ![]() ,
,
![]() ,
,
![]() ,
,
![]() додали розчин сульфатної кислоти. В
яких випадках відбулися реакції? Написати
їх іонні та молекулярні рівняння.
додали розчин сульфатної кислоти. В
яких випадках відбулися реакції? Написати
їх іонні та молекулярні рівняння.
135.
Скласти іонні та молекулярні рівняння
реакцій, які перебігають між речовинами:
![]() та
та ![]() ,
,
![]() та
та
![]() ,
,
![]() та
та ![]() .
.
Яку масу натрій нітрату необхідно взяти для приготування: а) 100 г розчину з масовою часткою 30 %; б) 250 мл 0,3 М розчину; с) 420 мл 0, 45 н. розчину.
Яку масу динатрій сульфату необхідно взяти для приготування: а) 100 г розчину з масовою часткою 50 %; б) 350 мл 0,25 М розчину; с) 400 мл 0, 5 н. розчину.
Яку масу нікель(II) сульфату необхідно взяти для приготування: а) 150 г розчину з масовою часткою 10 %; б) 350 мл 0,2 М розчину; с) 500 мл 0, 5 н. розчину.
Яку масу купрум(II) сульфату необхідно взяти для приготування: а) 350 г розчину з масовою часткою 10%; б) 350 мл 0,2 М розчину; с) 500 мл 0, 5 н. розчину.
Яка маса калій хлориду міститься в 400 мл розчину з молярною концентрацією 0,3 мольл?
Який об’єм води потрібен для того, щоб розчиненням 40 г
 одержати розчин з масовою часткою
одержати розчин з масовою часткою  8 %?
8 %?Маємо 0,01 н. розчин барій(II) гідроксиду

 .
Розрахувати молярність, моляльність
розчину та масову частку барій(II)
гідроксиду в розчині.
.
Розрахувати молярність, моляльність
розчину та масову частку барій(II)
гідроксиду в розчині.Розрахувати моляльність розчину глюкози (
 ),
якщо в 280 г води її міститься 40 г?
),
якщо в 280 г води її міститься 40 г?У 400 г води розчинено 10 г сахарози (
 ).
Визначити моляльність одержаного
розчину?
).
Визначити моляльність одержаного
розчину?У 450 г розчину містится 30 г дикалій сульфату. Знайти масову частку дикалій сульфату в розчині. Чому дорівнює моляльність цього розчину?
У 750 г розчину знаходиться 50 г ферум(II) сульфату. Чому дорівнює моляльність цього розчину?
У 300 г розчину знаходиться 50 г купрум(II) сульфату. Розрахувати моляльність цього розчину.
Cкільки води треба додати до 100 мл розчину нітратної кислоти з масовою часткою 48 %, густина якої 1,303 гсм3, щоб отримати розчин з масовою часткою 20 %?
Визначте масову частку розчину нітратної кислоти, якщо до 500 г її розчину з масовою часткою 32 % додати 1 л води?
150.Скільки
грамів ![]() треба взяти для приготування 300 г розчину
з масовою часткою 5 %, який розраховується
на безводну сіль?
треба взяти для приготування 300 г розчину
з масовою часткою 5 %, який розраховується
на безводну сіль?
151.Cкільки
кристалічної соди ![]() необхідно взяти для приготування 0,5 л
0,01 н. розчину?
необхідно взяти для приготування 0,5 л
0,01 н. розчину?
152.
Змішали
100 мл розчину сульфатної кислоти з
масовою часткою 50 % ![]()
![]() та 100 мл розчину сульфатної кислоти 50 з
масовою часткою 10 % (густина 1,07
та 100 мл розчину сульфатної кислоти 50 з
масовою часткою 10 % (густина 1,07 ![]() .
Суміш розбавили водою до 3 л. Визначити
нормальність одержаного розчину?
.
Суміш розбавили водою до 3 л. Визначити
нормальність одержаного розчину?
153.
Який об’єм
розчину сульфатної кислоти з масовою
часткою 96 % (густина 1,84 ![]() буде потрібний для приготування 3 л 0,4
н. розчину?
буде потрібний для приготування 3 л 0,4
н. розчину?
154.Які об’єми 2 та 6 М розчинів хлоридної кислоти треба змішати для одержання 0,5 л 3 М розчину?
Скільки води треба додати до розчину калій нітрату з масовою часткою 25%, щоб приготувати 300 г розчину з масовою часткою 7 %?
Яку кількість калій нітрату необхідно додати до 200 мл 0,1 н. розчину
 ,
щоб одержати розчин з концентрацією
0,15 н.?
,
щоб одержати розчин з концентрацією
0,15 н.?До якого об’єму необхідно розбавити 30 мл розчину
 з масовою часткою 20 %
з масовою часткою 20 %

 ,
щоб одержати розчин з молярною
концентрацією 0,5 мольл
,
щоб одержати розчин з молярною
концентрацією 0,5 мольл

 .
.Який об’єм води слід додати до 1 л 50 %-го розчину сульфатної кислоти
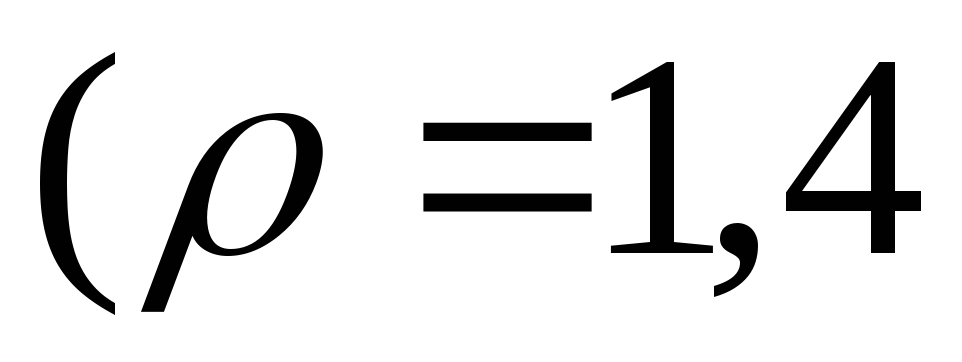
 щоб одержати 1 н. розчин
щоб одержати 1 н. розчин 
 .
.
Розрахувати масову долю
 в розчині, який одержали змішуванням
100 мл 10 %-го
в розчині, який одержали змішуванням
100 мл 10 %-го 
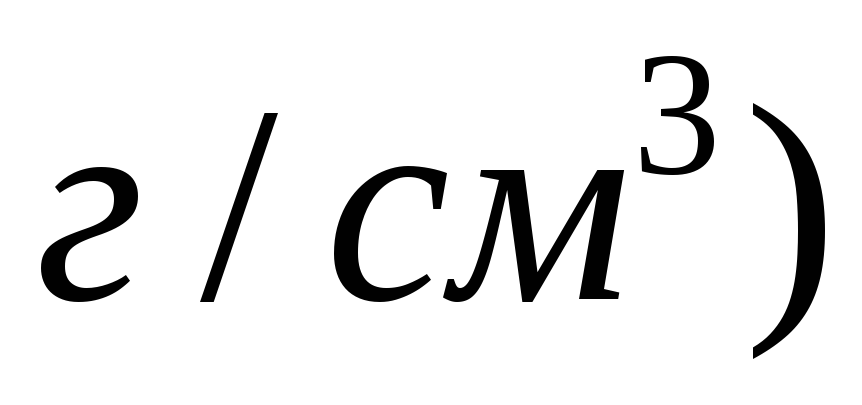 та 150 мл 20 %-го
та 150 мл 20 %-го 
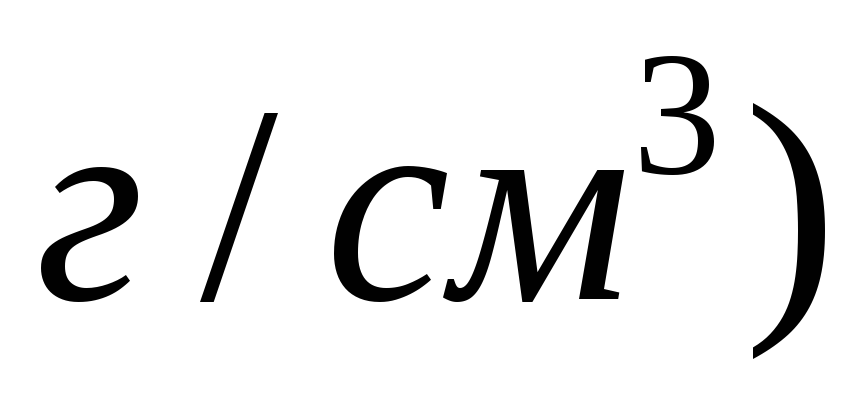 розчинів
розчинів
 .
.Яку масу нікель(II) сульфату необхідно додати до 250 мл 0,15 н. розчину
 ,
щоб довести концентрацію до 0,2 н.?
,
щоб довести концентрацію до 0,2 н.?Які об’єми 20 %-го

 та 6 %-го
та 6 %-го

 розчинів сульфатної
кислоти необхідно взяти для приготування
5 л 10 %-го розчину
розчинів сульфатної
кислоти необхідно взяти для приготування
5 л 10 %-го розчину 
 ?
?До 100 мл 0,25 н. розчину алюміній(III) нітрату додали 200 мл 0,6 М розчину цієї солі. Розрахувати молярну концентрацію еквіваленту одержаного розчину.
Чому дорівнюють маси барій хлориду безводного та кристалогідрату
 ,
які необхідно взяти для приготування
розчину об’ємом
1,5 л
,
які необхідно взяти для приготування
розчину об’ємом
1,5 л 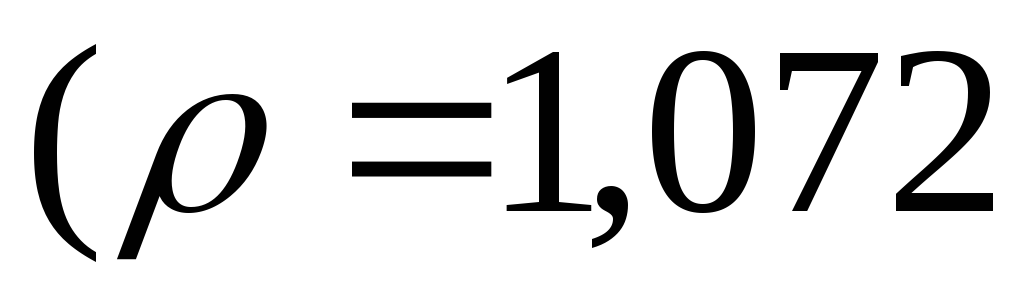
 ,
в якому
,
в якому
 =8
%? Який
об’єм
води необхідно взяти в першому та
другому випадках ?
=8
%? Який
об’єм
води необхідно взяти в першому та
другому випадках ?До 150 мл 0,15 М розчину аргентум нітрату додали 200 мл 0,2 н. розчину цієї солі. Розрахувати молярну концентрацію еквівалента одержаного розчину.
Який об’єм 5 %-го розчину натрій гідроксиду
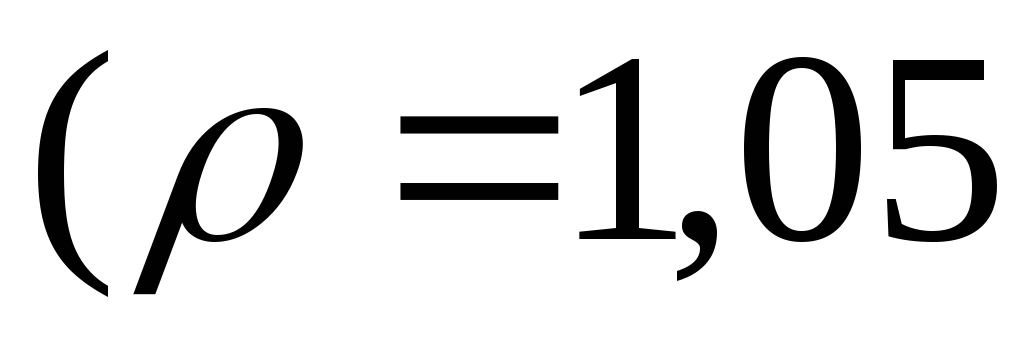
 необхідно додати до 100 мл 20 %-го розчину
необхідно додати до 100 мл 20 %-го розчину

 ,
щоб одержати 15 %-ний розчин ?
,
щоб одержати 15 %-ний розчин ?Які об’єми 50 %-го
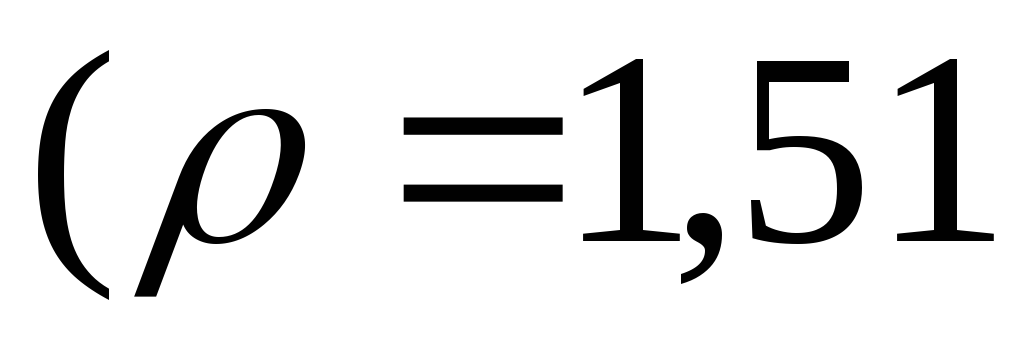
 і 10 %-го
і 10 %-го

 необхідно взяти для приготування 1 л
20 %-го розчину
необхідно взяти для приготування 1 л
20 %-го розчину

 ?
?Яка маса: а)
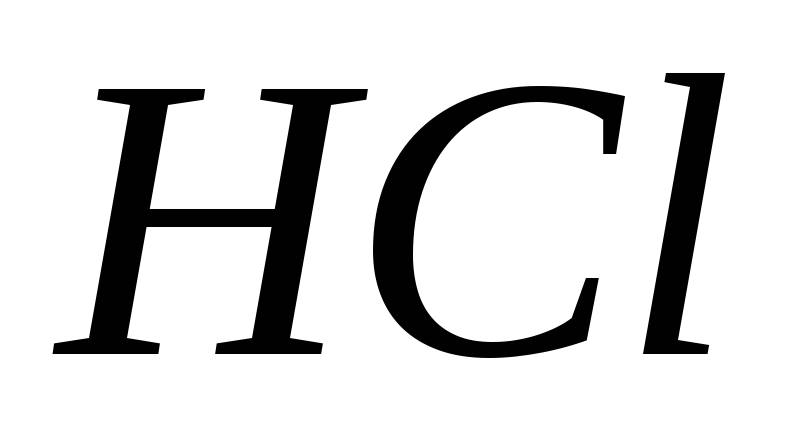 у розчині об’ємом 750 мл, якщо масова
частка хлоридної кислоти складає 10
%
у розчині об’ємом 750 мл, якщо масова
частка хлоридної кислоти складає 10
%

 ?
б)
?
б)
 у розчині об’ємом 200 мл, якщо
у розчині об’ємом 200 мл, якщо  =30
%
=30
%

 ?
?Чому дорівнює об’єм води, який необхідно додати до розчину масою 1 кг, щоб зменшити масову частку розчиненої речовини з 50 до 10 % ?
Після випарювання 10 %-го розчину


 об’ємом 6 л його маса стала дорівнювати
1420 г. Розрахуйте масову частку натрій
гідроксиду в одержаному розчині.
об’ємом 6 л його маса стала дорівнювати
1420 г. Розрахуйте масову частку натрій
гідроксиду в одержаному розчині.
170.Обчисліть молярну концентрацію та
нормальність розчину кальцій хлориду
з масовою часткою 20 %
![]()
![]() .
.
Чому дорівнює нормальність розчину натрій гідроксиду з масовою часткою 30 %

 ?
До 1 л цього розчину додали 5 л води.
Обчисліть мосову частку одержаного
розчину.
?
До 1 л цього розчину додали 5 л води.
Обчисліть мосову частку одержаного
розчину.Розрахувати масову частку
 у розчині, який одержали змішуванням
250 мл 10 %-го
у розчині, який одержали змішуванням
250 мл 10 %-го

 та 50 мл 20 %-го
та 50 мл 20 %-го
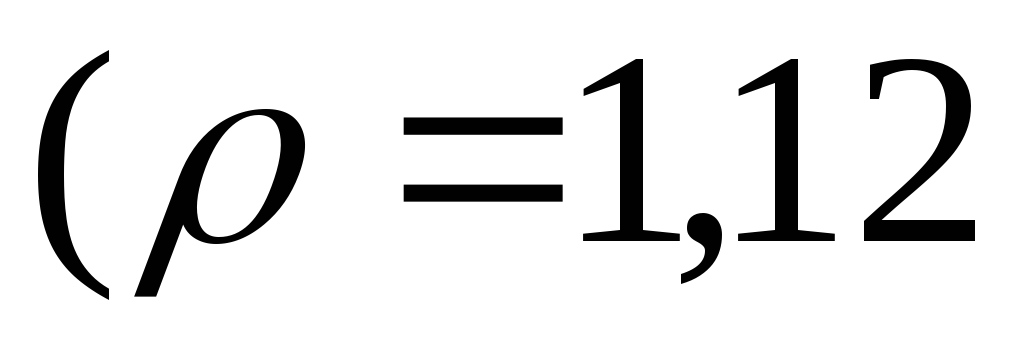
 розчинів
розчинів
 .
.Який об’єм розчину, в якому масова частка сульфатної кислоти складає 80 %

 ,
необхідно взяти для приготуваня 600 мл
розчину з молярною концентрацією
еквіваленту 0,1 мольл?
,
необхідно взяти для приготуваня 600 мл
розчину з молярною концентрацією
еквіваленту 0,1 мольл?Маємо 10 % розчин сульфатної кислоти

 .
Розрахувати молярність, молярну
концентрацію еквіваленту цього розчину.
.
Розрахувати молярність, молярну
концентрацію еквіваленту цього розчину.Якої маси кристалогідрат
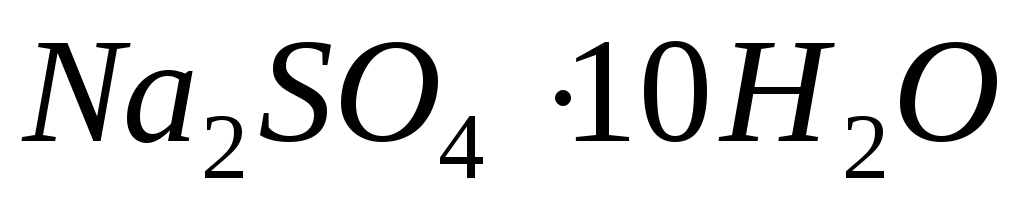 та вода якого об’єму знадобляться для
приготування розчину
та вода якого об’єму знадобляться для
приготування розчину 

 об’ємом 1,2 л з масовою часткою 10 %?
об’ємом 1,2 л з масовою часткою 10 %?У 350 г розчину міститься 10 г натрій хлориду. Розрахувати моляльність розчину та мольну долю натрій хлориду в розчині.
Яку масу дикалій карбонату необхідно додати до 200 мл 0,05 н. розчину
 ,
щоб довести концентрацію до 0,12
н.?
,
щоб довести концентрацію до 0,12
н.?До 30 мл 0,2 М розчину цинк нітрату додали 150 мл 0,2 н. розчину цієї солі. Розрахувати молярну концентрацію еквіваленту одержаного розчину.
179.
Маємо 25 % розчин хлоридної кислоти
![]()
![]()
![]() .
Розрахувати молярність, молярну
концентрацію еквіваленту цього розчину.
.
Розрахувати молярність, молярну
концентрацію еквіваленту цього розчину.
180.Розрахувати
масову долю нітратної кислоти у розчині,
який одержали змішуванням 200 мл 5 %-го ![]()
![]() та 150 мл 60 %-го
та 150 мл 60 %-го ![]()
![]() розчинів
розчинів ![]() .
.
Розрахувати
 0,2 н. розчину
0,2 н. розчину
 .
.Розрахувати
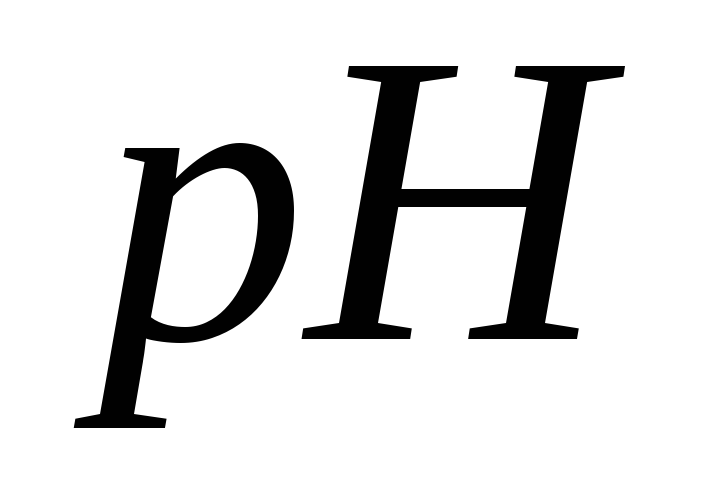 розчину, якщо
розчину, якщо  =3,5
=3,5
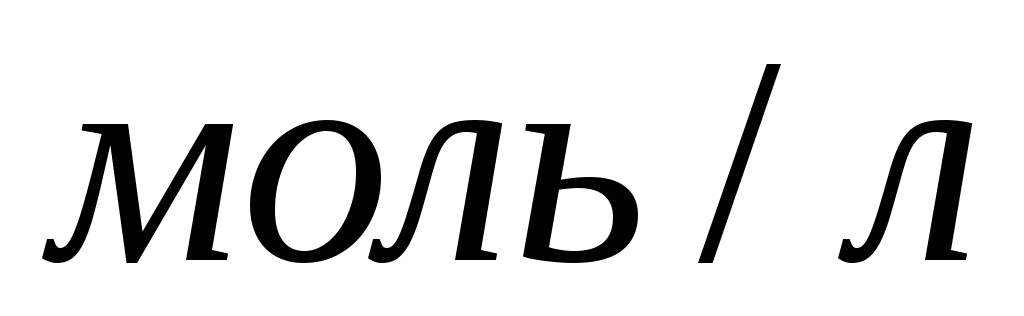 .
.Концентрація гідроксид-іонів у водному розчині дорівнює 110–3
 .
Визначити
.
Визначити
 та
та  розчину.
розчину.Концентрація гідроксид-іонів водного розчину дорівнює 510–2
 .
Визначити
.
Визначити  та
та  розчину.
розчину.Чому дорівнює
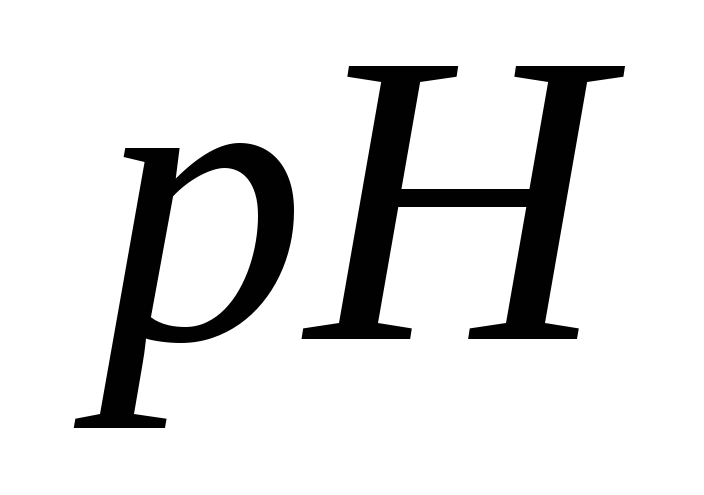 розчинів, в яких
розчинів, в яких
 дорівнює 0,15, 0,01, 10–6,
10–11
дорівнює 0,15, 0,01, 10–6,
10–11
 ;
;
 дорівнює 0,1 та 10–10
дорівнює 0,1 та 10–10
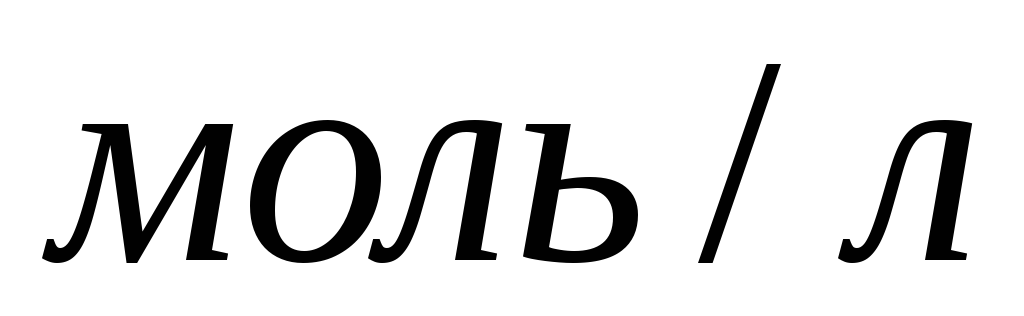 ?
?Знайти концентрацію
 та
та
 іонів в розчинах, для яких
іонів в розчинах, для яких
 дорівнює: а)
5; б) 10,5.
дорівнює: а)
5; б) 10,5.Розрахувати концентрацію іонів
 та
та
 в розчинах, якщо концентрація
в розчинах, якщо концентрація
 дорівнює: a)
10–6
дорівнює: a)
10–6
 ;
б) 410–2
;
б) 410–2
 .
.Чому дорівнює
 у 0,05 н. розчині
у 0,05 н. розчині
 ,
якщо 0,01?
,
якщо 0,01?Визначити
 та
та

 розчину кислоти, якщо
розчину кислоти, якщо
 дорівнює 3?
дорівнює 3? Визначити
 та
та
 розчину кислоти, якщо
розчину кислоти, якщо дорівнює 2,5?
дорівнює 2,5? Розрахувати
 0,1 М розчину сульфатної кислоти, якщо
ступінь її дисоціації дорівнює 90 %.
0,1 М розчину сульфатної кислоти, якщо
ступінь її дисоціації дорівнює 90 %.Розрахувати концентрацію гідроген-іонів в 0,2 н. розчині
 ,
якщо ступінь дисоціації її в цьому
розчині дорівнює 0,045 %.
,
якщо ступінь дисоціації її в цьому
розчині дорівнює 0,045 %.Чому дорівнює ступінь дисоціації етаноатної кислоти в 0,01 н. розчині, якщо

Яке значення рН мають розчини
 ,
в яких ступінь дисоціації кислоти
дорівнює: а) 0,0265 %; б) 0,0084 %?
,
в яких ступінь дисоціації кислоти
дорівнює: а) 0,0265 %; б) 0,0084 %?Степінь дисоціації
 у розчині
з концентрацією 0,1
у розчині
з концентрацією 0,1
 дорівнює 0,08 %. При якій концентрації
розчину вона збільшиться: в 2 рази, в 10
раз?
дорівнює 0,08 %. При якій концентрації
розчину вона збільшиться: в 2 рази, в 10
раз?Розрахуйте
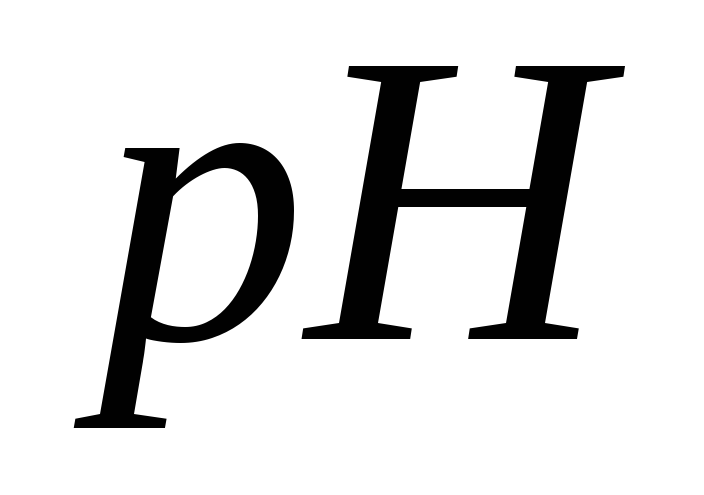 0,171 %-ного розчину барій(II)
гідроксиду, якщо
1, а густину розчину прийняти рівною 1
гсм3.
0,171 %-ного розчину барій(II)
гідроксиду, якщо
1, а густину розчину прийняти рівною 1
гсм3.Розрахувати молярну концентрацію кислоти
 у розчині, якщо
у розчині, якщо  =5,8;
=5,8;
0,001.
198.
Як зміниться ![]() 0,2 М розчину хлоридної кислоти після
додавання до нього рівного об’єму води?
0,2 М розчину хлоридної кислоти після
додавання до нього рівного об’єму води?
199.
Змішали рівні об’єми розчинів сильних
кислот з ![]() та
та ![]() .
Розрахувати
.
Розрахувати ![]() та
та ![]() одержаного розчину.
одержаного розчину.
200.
Як зміниться ![]() розчину після додавання до 300 мл 0,3 н.
розчину
розчину після додавання до 300 мл 0,3 н.
розчину ![]() 200 мл води?
200 мл води?
Розрахувати концентрацію гідроген-іонів в розчині калій гідроксиду ( 1), якщо відомо, що в 10 мл розчину міститься 0,028 г
 .
.Розрахувати концентрацію гідроген-іонів в 0,1 н. розчині етаноатної кислоти (Кд = 1,810–5).
Яку молярну концентрацію мають розчини
 та
та
 ,
якщо
,
якщо
 їх розчинів дорівнюють 1,6 та 12,6 відповідно?
їх розчинів дорівнюють 1,6 та 12,6 відповідно?Чому дорівнює
 розчинів, в яких
розчинів, в яких
 дорівнює 0,1, 0,001, 10–7,
10–10
мольл;
дорівнює 0,1, 0,001, 10–7,
10–10
мольл;
 дорівнює 0,01 та 10–11
дорівнює 0,01 та 10–11
 ?
?
205.
Розрахуйте
![]() 0,002 н. розчину нітратної кислоти.
0,002 н. розчину нітратної кислоти.
206.
Скільки води слід додати до 200 мл хлоридної
кислоти з ![]() 2, щоб змінити величину рН на одиницю?
2, щоб змінити величину рН на одиницю?
Скільки грамів хлоридної кислоти слід додати до 2 л її розчину з
 3,5, щоб знизити
3,5, щоб знизити
 розчину до 3 ?
розчину до 3 ?Розрахувати
 0,2 М розчині сульфатної кислоти, якщо
ступінь її дисоціації дорівнює 90%.
0,2 М розчині сульфатної кислоти, якщо
ступінь її дисоціації дорівнює 90%.У розчині
 концентрації 0,15
концентрації 0,15  ступінь її дисоціації дорівнює 0,08 %.
При якій концентрації розчину вона
збільшиться: в 3 рази, в 10 раз?
ступінь її дисоціації дорівнює 0,08 %.
При якій концентрації розчину вона
збільшиться: в 3 рази, в 10 раз?Знайдіть та концентрацію гідроген-іонів у наступних розчинах кислот:
|
Формула кислоти |
Молярна концентрація, мольл |
Константа дисоціації |
|
|
0,001 |
|
|
|
0,1 |
|
|
|
0,05 |
|
|
|
0,02 |
|
