
- •3. Коэффициент полезного действия тепловой машины. Цикл Карно.
- •4. Работа холодильника (теплового насоса).
- •5. Измерение рассеивания энергии. Энтропия.
- •6. Термодинамический взгляд на энтропию.
- •7. Вычисление энтропии.
- •8. Направление протекания процессов в изолированных системах и термодинамические условия равновесия.
- •9. Энергия Гиббса. Энергия Гельмгольца.
- •10. Направление протекания процессов в неизолированных системах и термодинамические условия равновесия.
- •11. Уравнение Гиббса - Гельмгольца.
- •12. Применение второго закона термодинамики к фазовым переходам. Уравнение Клаузиуса - Клапейрона.
- •13. Химическое равновесие. Закон действующих масс и константа равновесия.
- •14. Различные формы констант равновесия и связь между ними.
- •15. Уравнение изотермы химической реакции. Химическое сродство.
- •16. Направление реакций и условие равновесия.
- •17. Зависимость константы равновесия от температуры и давления.
- •18. Равновесие в гетерогенных системах.
- •19. Термическая диссоциация.
мо, чтобы в каждой своей бесконечно малой стадии состояние системы, в которой этот процесс происходит, отвечало бы состоянию равновесия.
Состояние равновесия – особое состояние термодинамической системы, в которое она переходит в результате обратимого или необратимого процессов и может оставаться в нем бесконечно долго. Реальные процессы могут приближаться к обратимым, но для этого они должны совершаться медленно.
Процесс называется необратимым (естественным, спонтанным, самопроизвольным), если он сопровождается рассеянием энергии, т. е. равномерным распределением между всеми телами системы в результате процесса теплопередачи.
В качестве примеров необратимых процессов могут быть названы следующие:
замерзание переохлажденной жидкости;
расширение газа в вакуумированное пространство;
диффузия в газовой фазе или в жидкости.
Систему, в которой произошел необратимый процесс, можно возвратить в исходное состояние, но для этого над системой нужно совершить работу.
К необратимым процессам относится большинство реальных процессов, так как они всегда сопровождаются работой против сил трения, в результате чего происходят бесполезные энергозатраты, сопровождающиеся рассеянием энергии.
Для иллюстрации понятий рассмотрим идеальный газ, находящийся в цилиндре под поршнем. Пусть начальное давление газа Р1 при его объеме V1 (рис. 4.1).
Д

Если с поршня снять некоторое количество песка, то давление газа над поршнем резко снизится (от А до В) лишь после чего произойдет увеличение объема газа до равновесной величины (от В до С). Характер этого процесса – ломанная линия 2. Эта линия характеризует зависимость P=f (V) при необратимом процессе.
Рис.
4.1. Зависимость давления газа от его
объема при обратимом (1) и необратимом
процессах (2, 3).
Таким образом, любой термодинамический процесс характеризуется максимально возможной величиной работы, если он совершается в обратимом режиме. К аналогичному выводу можно прийти, если рассмотреть процесс сжатия газа. Только следует иметь ввиду, что в этом случае величина работы – отрицательная величина (рис. 4.1, ломаная 3).
3. Коэффициент полезного действия тепловой машины. Цикл Карно.
Классический пример применения второго начала термодинамики – определение максимально возможного коэффициента полезного действия (К. П. Д.) тепловой машины. Исторически исследования в этой области послужили исходным пунктом термодинамики. Из положений второго начала следует, что тепловая машина должна содержать не менее двух тел, находящихся при разных температурах: нагревателя при температуре Т1 и холодильника при температуре Т2 (Т1>Т2). Для получения максимальной работы, перенос энергии от нагревателя к холодильнику должен осуществляться в обратимом режиме. Для осуществления переноса необходимо участие еще одного, так называемого рабочего тела, совершающего обратимый циклический процесс.
Отношение
совершенной рабочим телом работы к
сообщенной рабочему телу энергии –
К.П.Д. тепловой машины (![]() ):
):
![]() ,
(4.1)
,
(4.1)
где А – совершенная рабочим телом полезная работа;
q1 – энергия, полученная рабочим телом от нагревателя в результате теплопередачи;
q2 – энергия, теплопередачей возвращенная рабочим телом холодильнику.
Схема тепловой машины может быть представлена рис. 4.2.

Рис.4.2.
Схема тепловой машины.
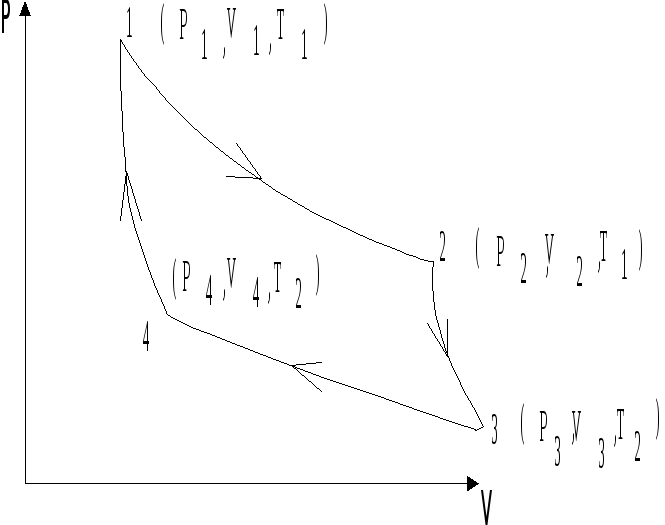
Все указанные на рис. 4.3 процессы являются обратимыми, поэтому исходное и конечное состояния газа совпадают. Рабочим телом является идеальный газ в количестве 1 моля, находящийся в цилиндре под поршнем.
Рис.
4.3. Цикл Карно.
![]() .
(4.2)
.
(4.2)
При адиабатическом расширении газа (2 – 3) цилиндр с поршнем отсоединяется от нагревателя и работа расширения газа выполняется за счет уменьшения его внутренней энергии:
![]() .
(4.3)
.
(4.3)
Изотермическое сжатие (3 – 4) газа происходит в условиях контакта цилиндра с холодильником (теплоприемником), а энергия, выделяющаяся при сжатии полностью поглощается холодильником:
![]() .
(4.4)
.
(4.4)
Работа,
произведенная на последнем участке (4
– 1)
цикла производится в условиях отсутствия
контакта рабочего тела с холодильником
и приводит к повышению запаса внутренней
энергии газа и его температура
увеличивается до Т2:
![]() .
.
Суммарная величина работы, выполненная рабочим телом за цикл определяется:
![]() .
(4.5)
.
(4.5)
Из уравнений адиабат:
![]() ,
(4.6)
,
(4.6)
![]() ,
(4.7)
,
(4.7)
следует:
![]() .
(4.8)
.
(4.8)
Следовательно (4.5) с учетом (4.8) примет вид:
![]() .
(4.9)
.
(4.9)
Тогда К. П. Д. вычисляется:
 ,
(4.10)
,
(4.10)
окончательно:
![]() .
(4.11)
.
(4.11)
Соотношение (4.11), полученное для цикла Карно, можно рассматривать как аналитическое выражение второго начала термодинамики. Из (4.11) следует, что К. П. Д. тепловой машины зависит только от температур нагревателя и холодильника и он тем больше, чем ниже Т2.
Можно
доказать, что К. П. Д. цикла Карно,
состоящего из обратимых процессов,
больше К.П.Д. любого другого цикла (![]() ),состоящего
из нескольких обратимых процессов
(теорема Карно):
),состоящего
из нескольких обратимых процессов
(теорема Карно):
![]() .
(4.12)
.
(4.12)
Высокое значение К. П. Д. цикла Карно является следствием не его специфической формы, а обратимостью всех его составляющих.
Из соотношения (4.12) следует:
![]()

![]() ,
(4.13)
,
(4.13)
откуда:
![]() .
(4.14)
.
(4.14)
Неравенство (4.14) - одна из форм записи второго начала термодинамики.
