
4. Электропроводность растворов электролитов.
Способность вещества проводить электричество называется электропровоностью или, наоборот, электросопротивлением:
![]() ,
(8.14)
,
(8.14)
где ![]() -
электропроводность, Ом-1
или См (сименс);
-
электропроводность, Ом-1
или См (сименс);
R - электросопротивление, Ом.
Электросопротивление проводника определяется его геометрией и природой:
![]() ,
(8.15)
,
(8.15)
где l - длина проводника, м;
S - сечение проводника, м2;
![]() - удельное
электросопротивление, Ом
- удельное
электросопротивление, Ом![]() м.
м.
Удельная электропроводность.
В электрохимии вместо удельного электросопротивления принято пользоваться величиной удельной электропроводности, определяемой из выражения:
![]() ,
(8.16)
,
(8.16)
где ![]() - удельная электропроводность, Ом-1
- удельная электропроводность, Ом-1![]() м-1.
м-1.
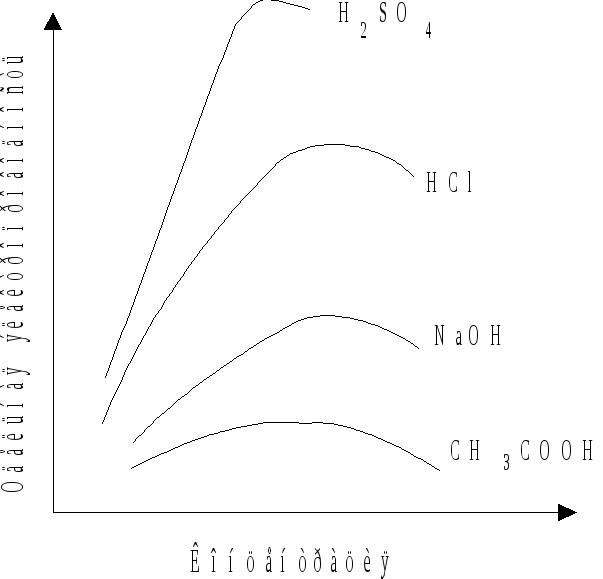
Рис. 8.1. Схема
концентрационной зависимости удельной
электропроводности водных растворов.
Так как перенос электричества в растворе электролита осуществляется движением ионов, то удельная электропроводность тем выше, чем больше их концентрация в электролите и скорость их миграции.
Обычно зависимость удельной электропроводности водных растворов электролитов выражается кривой с максимумом (рис. 8.1). Ход кривой объясняется следующим образом: чистая вода - хороший диэлектрик; электрическая проводимость возникает при введении в воду первых порций электролита и увеличивается по мере добавления новых порций электролита; при достаточно большой концентрации проявляется взаимное влияние ионов и электропроводность уменьшается.
С ростом температуры
электропроводность растворов электролитов
увеличивается: при повышении температуры
на 1 К
![]() увеличивается на 2
увеличивается на 2![]() 3
%.
3
%.
Эквивалентная электропроводность.
Изучение электрохимии
упрощается, если сравнивать
электропроводности растворов электролитов
независимо от случайного выбора их
концентраций. Для этого удельную
электропроводность
![]() относят к одной и той же концентрации
С, выраженной в моль-экв/м32
:
относят к одной и той же концентрации
С, выраженной в моль-экв/м32
:
![]() ,
(8.17)
,
(8.17)
где
![]() - эквивалентная электропроводность,
Ом-1
- эквивалентная электропроводность,
Ом-1![]() м2
м2![]() моль-экв-1;
моль-экв-1;
V - разбавление (разведение) электролита, м3/моль.
В размерности эквивалентной электропроводности последний сомножитель часто не указывается.
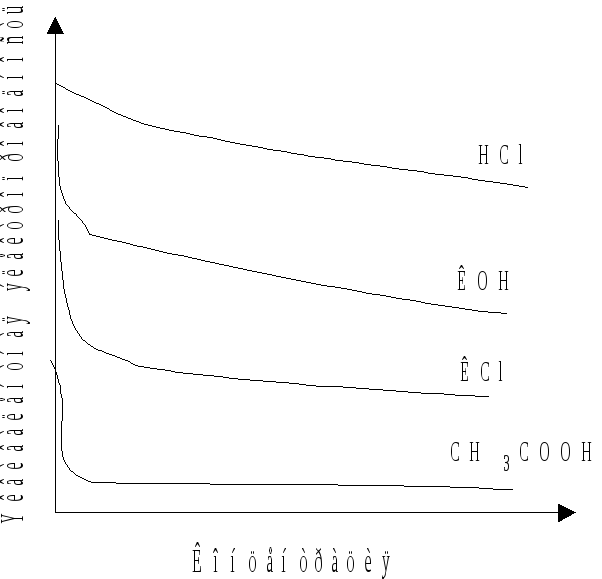
Согласно (8.17) с увеличением концентрации электролита эквивалентная электропроводность уменьшается (рис. 8.2).
Из рис. 8.2 следует,
что в зависимости от характера изменения
![]() =f (С)
растворы электролитов делятся на сильные
и слабые электролиты: в растворах сильных
электролитов
=f (С)
растворы электролитов делятся на сильные
и слабые электролиты: в растворах сильных
электролитов
![]() сохраняет высокие значения и при высоких
концентрациях растворов.
сохраняет высокие значения и при высоких
концентрациях растворов.
Рис. 8.2. Схема
концентрационной зависимости
эквивалентной электропроводности
водных растворов.
![]() =f (С)
объясняется, главным образом, уменьшением
степени электролитической диссоциации
при повышении концентрации.
=f (С)
объясняется, главным образом, уменьшением
степени электролитической диссоциации
при повышении концентрации.
Когда растворы обоих типов электролитов приближаются к бесконечно разбавленным, деление электролитов на слабые и сильные становится весьма условным.
Зависимость эквивалентной электропроводности разбавленных растворов слабых электролитов выражается уравнением закона разбавления Оствальда:
![]() ,
(8.18)
,
(8.18)
где ![]() - эквивалентная
электропроводность при бесконечном
разбавлении раствора.
- эквивалентная
электропроводность при бесконечном
разбавлении раствора.
Закон разбавления Оствальда получен на основе закона действующих масс и выражения:
![]() .
.
Линеаризация закона разбавления приводит к выражению вида:
![]() .
(8.18)
.
(8.18)
Зависимость эквивалентной электропроводности разбавленных растворов сильных электролитов от концентрации хорошо передается широко оправдавшей себя формулой Кольрауша (1900 г.):
![]() ,
(8.19)
,
(8.19)
где а - постоянная величина.
