
27+
.pdf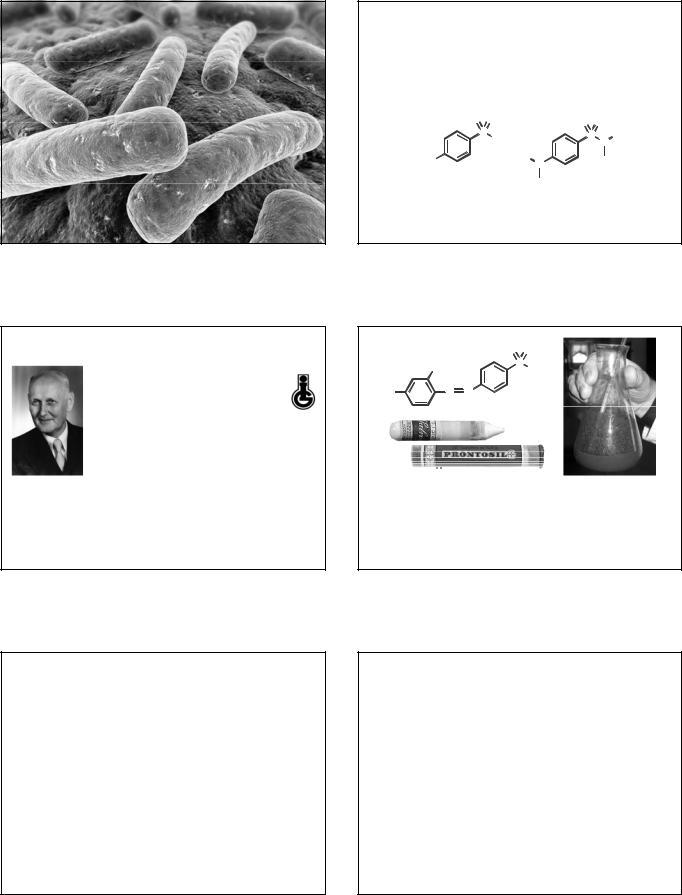
Жерносек А.К. Лекции по фармацевтической химии
ЛЕКЦИЯ 27-28
СИНТЕТИЧЕСКИЕ
АНТИБАКТЕРИАЛЬНЫЕ
СРЕДСТВА
ИСТОРИЯ СОЗДАНИЯ
1927 г. - Германский химический концерн «И.Г. Фарбениндустри» пригласил Г.Домагка на должность директора экспериментальной НИЛ патологии и бактериологии (с 1929 – НИИ). Домагк начал систематический поиск возможного применения новых красителей в медицинской практике.
Герхардт Йоханнес |
1932 г. Обнаружено, что |
Пауль Домагк |
азокраситель «пронтозил», |
(Gerhard Johannes Paul |
синтезированный Ф. Митчем и |
Domagk ) (1895-1964). |
Дж. Кларером, эффективен |
Немецкий патолог и |
против стрептококковых |
бактериолог. |
инфекций у мышей. |
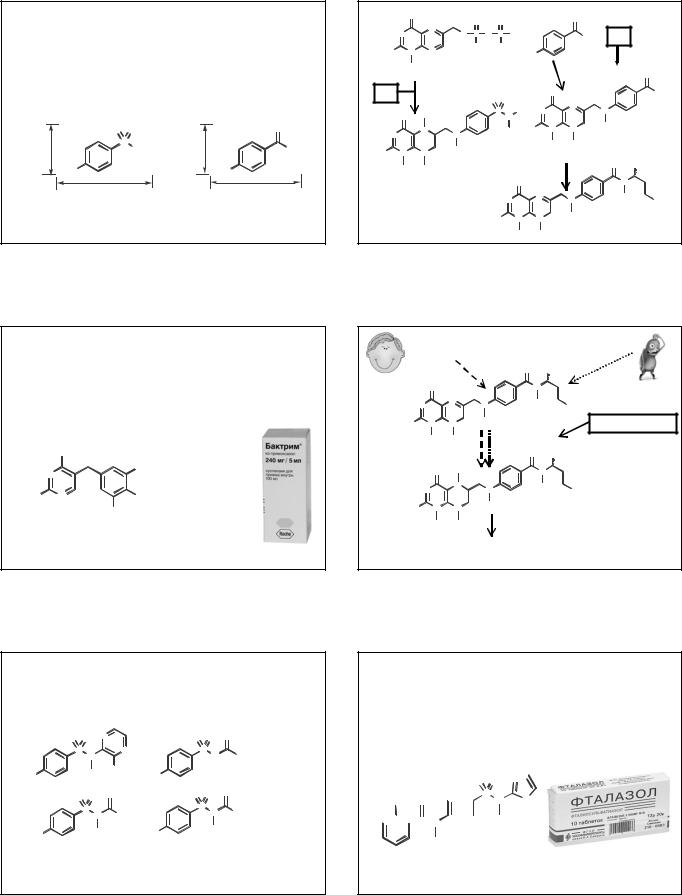
1935 г. - Жак и Тереза Трефо (Jacques and Thérèse Trefouel) из Института Пастера (Франция) обнаружили, что пронтозил не действует на бактерии in vitro, но становится активным в присутствии восстановителя. Позднее ими было установлено, что в организме пронтозил восстанавливается до сульфаниламида, обладающего антимикробным действием. Сульфаниламид был синтезирован в 1908 году венским студентом-химиком Паулем Гельмо.
1940 г. – Установлено (Woods), что сульфаниламиды являются антагонистами п-АБК, которая служит фактором роста бактерий. В дальнейшем было установлено, что сульфаниламиды блокируют фермент дигидрофолатсинтетату и нарушают процесс синтеза фолиевой кислоты
СУЛЬФАНИЛАМИДЫ
Сульфаниламиды – лекарственные средства антимикробного действия, являющиеся
производными амида сульфаниловой кислоты (4-аминобензолсульфамида).
O O |
|
O O |
S NH2 |
|
S N R1 |
H2N |
R2 N |
H |
|
H |
|
Обладают широким спектром действия (но как антимикробные ЛС системного действия практически не используются).
|
|
O O |
|
NH2 |
S NH2 |
H2N |
N |
N |
1935 г. (15.02) Домагк опубликовал статью «Вклад в химиотерапию бактериальных инфекций» в журнале
«Deutsche Medizinische Wochenschrift».
1939 г. Домагк награждён Нобелевской премией по физиологии и медицине «за открытие антибактериального эффекта пронтозила.
Вторая половина 1930-х - первая половина 1940-х
- широкое применениее СА.
Конец 1940-х - уменьшение интереса к СА, что было вызвано появлением большого числа САустойчивых
штаммов СА и началом широкого использования АБ. Середина 1950-х – начало 1960-х - «ренессанс» применения СА, связанный с появлением СА длительного и сверхдлительного действия.
В настоящее время СА как антибактериальные ЛС системного действия практически не используются.
При изучении побочного действия СА открыты другие группы ЛС, содержащие в молекуле сульфамоильную группу (гипогликемические средства, ингибиторы карбангидразы и др.).
2011/2012
1
Жерносек А.К. Лекции по фармацевтической химии
СВЯЗЬ СТРУКТУРЫ И ДЕЙСТВИЯ
Сульфаниламиды – ЛС бактериостатического действия. Являются биоизостерами ПАБК. Ингибируют фермент дигидроптероатсинтазу у микроорганизмов.
|
O O |
O |
0,24 нм |
S NH2 0,23 нм |
OH |
|
H2N |
H2N |
|
0,69 нм |
0,67 нм |
Совместно с сульфаниламидами применяют триметоприм – ингибитор дигидрофолатредуктазы. Активность триметоприма в отношении ДФР E.coli в 100000 раз выше, чем в отношении аналогичного фермента человека. Триметоприм вместе с сульфаметоксазолом (в соотношении 1:5) входит в состав Ко-тримоксазола.
NH2 |
OCH3 |
N |
|
|
Триметоприм |
H2N N |
OCH3 |
|
OCH3 |
Триметоприм вместе с сульфаметоксазолом (в соотношении 1:5) входит в состав Ко-тримоксазола.
|
O |
|
|
|
O |
|
O |
|
|
|
O |
|
|
|
|
|
N |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|||
|
N |
|
O |
P |
O P |
OH |
|
|
OH |
СА |
|
||
|
|
|
+ |
|
|
||||||||
H2N |
N |
|
N |
|
OH |
OH |
|
|
|
|
|
||
|
|
|
|
|
H2N |
|
Дигидроптероатсинтаза |
||||||
|
H |
|
|
|
|
|
|
ПАБК |
|
||||
Дигидроптероатдифосфат |
|
|
|
|
O |
||||||||
СА |
|
|
|
|
|
O O |
|
O |
N |
|
OH |
||
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
S N R |
N |
|
N |
|
||
|
O |
H |
|
|
|
|
|
|
|
||||
|
|
N |
|
|
|
|
|
H H2N |
N |
N |
H |
|
|
N |
|
N |
|
|
|
|
|
|
|||||
|
|
|
H |
|
|
|
|
|
|
H |
H |
|
|
H2N |
N |
N |
|
|
|
|
|
Дигидроптероевая кислота |
|||||
|
|
|
|
|
|
||||||||
|
H |
H |
|
|
|
|
|
|
|
|
|
O |
COOH |
«Ложный» метаболит |
|
|
|
O |
|
|
|
N |
|
||||
(у некоторых МО) |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
N |
N |
|
N |
H |
COOH |
||||
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
H2N |
N |
N |
|
H |
|
|
|
|
|
|
|
|
|
Дигидрофолиевая кислота |
|||||||
|
|
|
|
|
|
|
|
H |
H |
||||
Фолиевая кислота |
|
синтез |
||||
(витамин) |
|
|
||||
|
ДФР |
|
O |
|
COOH |
|
|
|
|
|
|
||
|
O |
|
|
|
N |
COOH ДГФК |
N |
N |
|
N |
H |
||
H2N |
N |
N |
|
H |
|
Триметоприм |
|
|
|
||||
|
H |
H |
ДФР |
Дигидрофолатредуктаза (микробная) |
||
|
|
|
||||
|
|
|
O |
COOH |
||
|
|
|
|
|||
|
O |
H |
|
N |
ТГФК |
|
|
|
N |
|
H |
||
|
N |
N |
COOH |
|||
|
|
|
|
|||
H2N |
N |
N |
H |
|
|
|
|
|
|
||||
|
H |
H |
|
|
|
|
Перенос одноуглеродных групп, использующихся при |
||||||
синтезе пуриновых нуклеотидов, дезоксиТМФ, АК. |
||||||
У большинства СА один из атомов водорода в сульфамоильной группе замещён на гетероцикл, ацетил, остаток гуанидина или мочевины. Это повышает антимикробную активность (увеличивает кислотные свойства NH-кислотного центра).
|
O O N |
|
O O |
O |
|
|
|
S N |
N |
|
S N |
|
CH3 |
H2N |
H |
OCH3 |
H2N |
Na |
Как называются |
|
|
|
|
|
эти ЛС? |
||
|
O O |
NH |
|
O O |
O |
|
|
S N |
NH2 |
|
S N |
|
NH2 |
H2N |
H |
|
H2N |
H |
|
|
|
|
|
|
|
||
Замещение двух атомов водорода при атоме азота сульфамоильной группы приводит к образованию неактивных соединений.
У некоторых СА заместители присутствуют как в сульфамоильной группе, так и в первичной ароматической аминогруппе. Второй заместитель является ацильным остатком дикарбоновой кислоты и используется для повышения гидрофильности соединения. Такие СА не всасываются в ЖКТ и используются для лечения микробных заболеваний ЖКТ.
O O N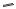 HOOC O
HOOC O 
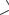 S
S N
N
 S
S

 N
N
 H
H
H
Фталилсульфатиазол
2011/2012
2
Жерносек А.К. Лекции по фармацевтической химии
Азопроизводные СА являются пролекарствами и используются для лечения неспецифического язвенного колита и болезни Крона.
|
|
O O |
|
|
|
|
|
|
S N |
N |
|
|
|
N |
N |
H |
|
|
O O |
|
|
|
|
|
|
||
|
|
|
|
S N |
|
|
HO |
|
|
NH2 |
|
N |
|
COOH |
|
|
H2N |
H |
|
|
HO |
|
|
||||
|
|
|
|
|
||
|
|
COOH |
|
COONa |
COONa |
|
Действующим компонентом |
HO |
|
||||
|
|
OH |
||||
таких ЛС является не |
|
|
|
|
|
|
сульфаниламид, а 5- |
|
|
|
N N |
|
|
аминосалициловая кислота. |
|
|
|
|||
|
Осалазин (нет СА) |
|||||
|
|
|
|
|||
СУЛЬФАНИЛАМИДЫ В АТХ
J01 Антибактериальные средства для системного применения
J01E Сульфаниламиды и триметоприм
J01EA Триметоприм и его производные
J01EA01 Триметоприм
J01EB СА короткого действия
J01EB06 Сульфаниламид
J01EС СА средней длительности
J01EС01 Сульфаметоксазол
J01ED СА длительного действия
J01ED01 Сульфадиметоксин J01ED02 Сульфален
J01ED Комбинации СА и триметоприма
J01EE01 Сульфаметоксазол + триметоприм
Длительность действия СА для системного применения зависит от их связывания с белками плазмы крови.
Введение в остаток гетероцикла метоксигрупп увеличивает продолжительность действия.
|
|
OCH3 |
|
|
|
O O N |
N |
O O |
N |
|
S N |
OCH3 |
S N |
N |
H N |
H |
H2N |
H |
OCH3 |
2 |
|
|
|
|
Сульфадиметоксин Сульфален (сверхдлительное действие, более 48 часов)
D06B Синтетические противомикробные средства для местного применения
D06BA Сульфаниламиды
D06BA01 Сульфадиазин серебра D06BA05 Сульфаниламид
|
Средства, применяемые в |
|
S01 |
||
офтальмологии |
||
|
S01A Противомикробные средства
S01AB Сульфаниламиды
S01AB04 Сульфацетамид
A07 |
Антидиарейные, кишечные |
КО-ТРИМОКСАЗОЛ (CO-TRIMOXAZOLE) |
|
|||||||
противовоспалительные/ |
СУЛЬФАМЕТОКСАЗОЛ |
ТРИМЕТОПРИМ |
|
|||||||
|
антимикробные средства |
|
||||||||
A07A |
|
Кишечные антимикробные средства |
(SULFAMETHOXAZOLE) |
(TRIMETHOPRIM) |
||||||
|
БИ-СЕПТИН |
|
|
|
CH3 |
|
NH2 |
|
||
|
|
|
|
|
|
|
|
|||
A07AB |
Сульфаниламиды |
БИСЕПТОЛ |
O O |
|
O |
N |
|
OCH3 |
||
|
|
A07AB02 Фталилсульфатиазол |
|
S |
|
|
|
|
||
|
|
|
N |
N |
|
|
|
|||
A07E |
|
Кишечные противовоспалительные |
|
|
|
H2N |
N |
OCH3 |
||
|
|
|
H |
|
||||||
|
H2N |
|
|
|
|
OCH3 |
||||
|
|
средства |
|
|
|
|
|
|||
|
|
|
4-амино-N-(5-метилизоксазол- |
5-(3,4,5-триметоксибензил)пиримидин- |
||||||
A07EC |
|
Аминосалициловая кислота |
3-ил)бензолсульфонамид |
|
2,4-диамин |
|
|
|||
|
Таблетки по 120 мг (100 + 20) и |
|
|
|||||||
|
|
и родственные агенты |
|
|
||||||
|
|
A07EC01 Сульфасалазин |
480 мг (400 + 80); суспензия для |
|
|
|||||
|
|
приёма внутрь 240 мг/5 мл; |
|
|
|
|||||
|
|
|
|
|
|
|||||
|
|
|
раствор для инфузий 80 + 16 мг. |
|
|
|||||
|
|
|
2011/2012 |
|
|
|
|
|
|
|
3
Жерносек А.К. Лекции по фармацевтической химии
СУЛЬФАДИАЗИН СЕРЕБРА |
|
СУЛЬФАСАЛАЗИН |
|
|||
(SILVER SULFADIAZINE) |
АРГЕЗИН* |
(SULFASALAZINE) |
|
|||
|
|
|
|
O O |
||
|
O O |
ДЕРМИЗИН |
|
|
||
|
|
|
S N N |
|||
|
СИЛВАДЕРМ |
|
|
|||
|
S N |
СИЛЬВАДЕРМА |
N |
N |
H |
|
H2N |
Ag |
СУЛЬФАРГИН |
|
|
||
|
|
HO |
|
|
||
серебра 4-амино-N-пиримидин-2- |
|
|
|
|||
илбензолсульфонамид |
|
COOH |
|
|
||
Крем, мазь и аэрозоль для наружного |
2-гидрокси-5-[2-[4-(пиридин-2- |
|||||
илсульфамоил)фенил]диазенил]бензойная кислота |
||||||
применения 10 мг/г (1%). |
|
|||||
|
Таблетки, покрытые плёночной оболочкой, и |
|||||
|
|
|
||||
|
|
|
таблетки, покрытые кишечнорастворимой |
|||
|
|
|
оболочкой, по 500 мг. |
|||
ПРИМЕРЫ СИНТЕЗА СУЛЬФАНИЛАМИДОВ И ТРИМЕТОПРИМА
Исходное вещество для синтеза СА - анилин. |
||||||
Сначала в анилине защищают аминогруппу, переводя |
||||||
её в карбаматную. Затем действием хлорсульфоновой |
||||||
кислоты получают сульфонилхлорид: |
O O |
|||||
|
|
|
|
|
|
|
|
|
COCl2 |
O |
HOSO2Cl |
O |
S Cl |
H |
N |
CH3OH H3CO |
N |
H CO |
N |
|
2 |
|
|
H |
3 |
H |
|
|
|
|
|
|
||
Сульфонилхлорид обрабатывают аммиаком или |
||||||
амином. В полученном соединении гидролизом (к |
||||||
или щ) освобождают ароматическую аминогруппу |
||||||
|
|
O O |
|
O O |
|
O O |
|
O |
S Cl RNH2 O |
S N RH+ (OH-) |
S N R |
||
H3CO N |
H3CO N |
H |
H2N |
H |
||
|
|
|||||
|
H |
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
O O |
|
CH3 |
|
|
O O |
O |
Триметоприм |
|
|
|
|
|
|
|
|
||||
|
O |
|
S |
Cl+ |
|
|
O |
S |
N |
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
HO |
|
|
|
||||||
|
|
|
|
|
|
H |
|
|
O |
|
|
|
|
|
|
||||||
H3CO |
N |
|
|
H |
N |
N |
H3C |
N |
|
|
|
|
этилформат |
|
|
|
|
|
|||
|
|
|
|
|
|
|
OCH3 |
|
|
|
|
|
|||||||||
|
H |
|
|
2 |
|
|
|
H |
NaOH |
|
|
H C |
O |
OHC O |
CH3 |
H C |
O |
|
|
OCH3 |
|
|
3-амино-5-метилизоксазол |
|
|
|
3 |
|
|
|
|
3 |
|
|
|
|
|||||||
|
|
|
|
|
|
|
Сульфаметоксазол |
|
|
|
OCH3 |
|
|
HN |
NH2 |
|
|
OCH3 |
|||
|
|
|
|
|
|
|
|
|
|
OCH3 |
|
|
NH2 |
C2H5ONa |
OCH3 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
этил 3-(3,4,5-триметоксифенил)пропаноат |
|
гуанидин |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
NH2 |
|
|
|
(гидрохлорид) |
|
|
|
|
|
|
|
|
|
|
1) NaNO2 |
|
|
|
|
|
|
OCH3 |
1) POCl3 |
OH |
|
|
|
|
||
|
|
O O |
|
|
|
|
|
|
|
|
|
N |
|
|
|
OCH3 |
|||||
|
|
|
|
|
2)H2N |
COOH |
|
|
|
|
N |
|
|
||||||||
|
|
S N |
|
|
|
|
|
|
|
|
2) NH3 |
|
|
|
|
|
|||||
|
|
|
N |
|
OH |
, KOH |
Сульфасалазин |
H2N |
N |
OCH3 |
|
H N |
N |
|
|
OCH |
3 |
||||
|
|
H |
|
|
|
|
|
|
|
OCH3 |
|
2 |
|
|
OCH3 |
||||||
H2N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
Сульфапиридин |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
2011/2012 |
|
|
|
|
|
|
|
|
|
|
4

Жерносек А.К. Лекции по фармацевтической химии
МЕТОДЫ КОНТРОЛЯ КАЧЕСТВА СУЛЬФАНИЛАМИДОВ И ТРИМЕТОПРИМА
Характеристика веществ
Сульфаниламид* |
Сульфамет |
Триметоприм |
Сульфасал |
Б или желтовато- |
Б(ПБ) КП |
Б или |
Ярко-желтый или |
белые кристаллы |
|
желтовато- |
коричневато- |
либо мелкий П |
|
белый П |
жёлтый тонкий П |
|
Сульфаниламид |
Сульфамет |
Триметоприм |
Сульфасал |
Вода |
М |
ПрН |
ОМ |
ПрН |
EtOH |
У |
У |
М |
ОМ |
Ацетон |
Л |
Р |
|
|
CH2Cl2 |
ПрН |
|
|
ПрН |
More |
К+, Щ+ |
К+, Щ+ |
|
Щ+ |
*Приведен для сравнения. Подробно фармакопейный анализ сульфаниламида (стрептоцида) изучался на 3 курсе!
Идентификация
Сульфаниламид |
Сульфамет |
Триметоприм |
Сульфасал |
|
ИК-спектрометрия |
|
|
|
|
УФ (0,1 М NaOH; |
В таблетках – |
|
|
интервал 230-350 нм |
УФ (ацетатный |
|
|
– max. при 287 нм; |
БР, 220-400 |
|
|
УПП = 240-250 |
нм) |
ТСХ |
ТСХ |
|
|
Tпл = 164,5-166 |
Tпл = 169-172 |
Tпл = 199-203 |
|
ПА амины |
ПА амины |
ИО + H2SO4 + |
|
|
|
щелочной р-р KMnO4, |
|
|
|
нагревают до |
|
|
|
кипения, затем + |
|
|
|
H2SO4 и HCHO. Охл., |
|
|
|
фильтруют. К |
|
|
|
фильтрату + CH2Cl2 – |
|
|
|
орг. слой имеет |
|
|
|
зелёную флуоресц. |
|
Чистота
|
Сульфаниламид |
Сульфамет |
Триметоприм |
Сульфасал |
П и Ц. |
|
+ (р-р NaOH) |
Ц+ |
|
К или |
К+ |
К+ |
|
|
Щ |
|
|
|
|
СПр |
ТСХ |
ВЭЖХ |
ВЭЖХ |
ВЭЖХ |
ТМ |
+ |
+ |
+ |
+ |
m |
+ |
+ |
н.б. 1% |
н.б. 1% |
CЗ |
+ |
+ |
+ |
+ |
ОКОР, |
+ |
+ |
+ |
|
МЧ |
|
|
|
|
+ more |
|
|
Анилин - ГЖХ |
Сал. к-та и |
|
|
|
|
сульфапир. |
|
|
|
|
– ВЭЖХ, |
|
|
|
|
хлориды, |
|
|
|
|
сульфаты |
Количественное определение
ЛС |
Метод |
Сульфаниламид |
Нитритометрия (КТТ – электром.) |
Сульфаметоксазол Нитритометрия (КТТ – электром.). В
таблетках и растворе для инфузий котримоксазола – аналогично. В суспензии ко-тримоксазола – фотометрия, основанная на реакции образования азокрасителя с N- 1-НЭДА
Триметоприм Ацидиметрия (безв. AcOH; 0,1 М HClO4;
потенц. КТТ; 1:1). В таблетках и др. ко-
тримоксазола – экстракция хлороформом из щел.среды, затем реэкстракция 1М AcOH и СФМ при 271 нм (УПП = 204)
Сульфасалазин СФМ – 359 нм (растворяют в растворе NaOH,
затем + AcOH). В таблетках - аналогично
Сульфадиазин серебра (JP 15)
Описание |
Белый или бледно-жёлтый кристаллический |
|
порошок без запаха. На свету постепенно |
|
окрашивается. Тпл 275 С (с разложением) |
Растворимость |
Практически нерастворим в воде, этаноле и |
|
эфире. Растворяется в растворе аммиака. |
Идентификация |
ИК-спектрометрия |
Чистота |
Нитраты (СФМ по реакции с хромотроповой |
|
и серной кислотами). |
|
СПр – ТСХ. |
|
m. |
|
Остаток при прокаливании – 41,0-45,0%. |
|
Содержание серебра – атомно-абсорбционная |
|
спектрометрия. |
Количественное |
Спектрофотометрия. ИО растворяют в растворе |
определение |
аммиака, затем разбавляют водой; 255 нм; |
|
сравнивают с поглощением р-ра станд. обр. |
2011/2012
5
Жерносек А.К. Лекции по фармацевтической химии
НИТРОФУРАНЫ
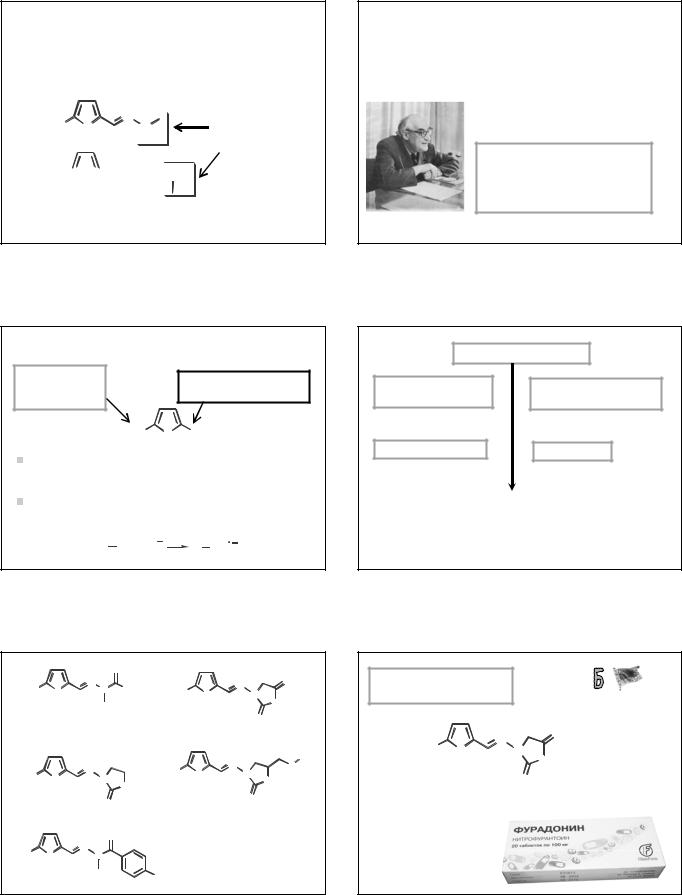
Нитрофураны – группа ЛС антимикробного действия, в основе которых лежат структуры:
5 |
|
2 N |
|
|
Может входить |
|
N |
||||
O2N O |
|
в состав |
|||
|
|
|
|||
|
|
|
|
|
гетероцикла |
|
|
|
|
|
|
O2N O
O

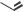
 N
N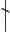 N
N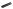
ИСТОРИЯ СОЗДАНИЯ
Предпосылка к созданию – изучение производных фурфурола – продукта переработки отходов СХ. Противомикробная активность производных 5-НФ впервые описана в 1944 г. (M.C.Dodd, W.B Stillman).
Исследования в СССР – со второй половины 1940-х годов – Институт химии древесины АН ЛатвССР.
Соломон Аронович Гиллер
(1915–1975)
Академик АН ЛатвССР, директор Института органического синтеза (Рига)
Оригинальное ЛС, созданное в СССР – фурагин.
СВЯЗЬ СТРУКТУРЫ И ДЕЙСТВИЯ |
||
Наличие |
|
Различия в активности |
антимикробной |
|
|
|
и спектре действия |
|
активности |
|
|
|
|
|
5 |
|
2 |
O2N |
O |
R |
Механизм действия: |
|
|
Нитрогруппа – акцептор кислорода. Нарушают |
||
процесс клеточного дыхания. Ингибируют различные |
||
О-В ферменты. |
|
|
Под действием микробных флавопротеинов –NO2 |
||
восстанавливается до продуктов, обладающих |
||
цитотоксическим действием |
|
|
R NO2 + e |
|
R NO2 |
СПЕКТР ДЕЙСТВИЯ |
|
Грамотрицательные |
Грамположительные |
аэробные бактерии |
аэробные бактерии |
E.coli, Shigella sp., |
Staphylococcus sp., |
Salmonella sp. и др. |
Streptococcus sp. и др. |
Патогенные грибы |
Простейшие |
Candida albicans, |
Trichomonas vaginalis, |
Microsporum sp. и др. |
Lamblia intestinalis и др. |
Неактивны в отношении анаэробов и |
|
псевдомонад |
|
|
|
|
O |
|
|
|
|
O |
|
O2N O |
N N NH2 |
O2N O |
N |
|
|
||||
N |
NH |
|
|||||||
Нитрофурал |
H |
|
Нитрофурантоин |
|
|
||||
|
|
O |
|
|
|||||
Применяется только наружно |
Микробные заболевания МВП |
||||||||
|
|
N |
|
|
|
N N |
|
S |
CH3 |
O2N |
O |
N |
|
O2N O |
|
|
|||
|
O |
Нифурател |
|
|
O |
|
|||
Фуразолидон |
O |
O |
|
|
|||||
|
|
|
|
||||||
Микробные заболевания ЖКТ |
Используется в гинекологии: |
|
|||||||
|
|
|
|
|
антимикробное, антитрихомонадное |
||||
|
|
|
O |
|
и фунгистатическое средство |
|
|||
|
|
N |
|
Нифуроксазид |
|
|
|||
O2N |
O |
N |
|
|
|
||||
|
|
Микробные заболевания ЖКТ. |
|||||||
|
|
|
H |
|
|||||
|
|
|
|
OH Практически не всасывается |
|||||
|
|
|
|
|
|||||
НИТРОФУРАНТОИН
(NITROFURANTOIN)
O2N |
O |
N |
N |
O |
ФУРАДОНИН |
|
NH |
|
|||
|
|
|
|
|
|
|
|
|
O |
|
|
1-[[(5-нитро-2-фуранил)метилен]амино]имидазолидин-2,4-дион
Таблетки по 50 и 100 мг.
2011/2012
6
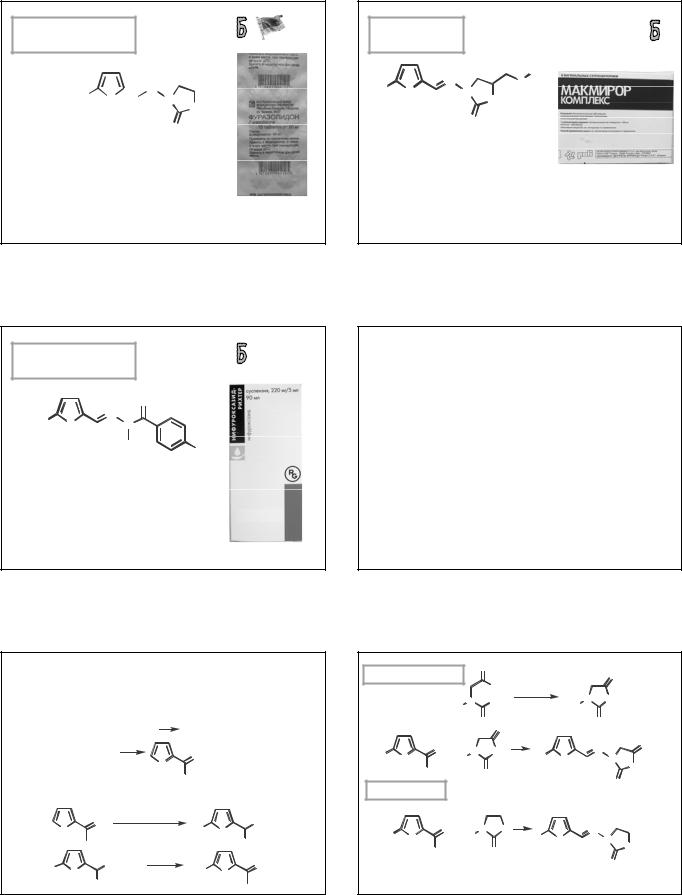
Жерносек А.К.
ФУРАЗОЛИДОН
(FURAZOLIDONE)
O2N
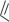 O
O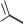
 N N
N N
 O
O
O
3-[[(5-нитро-2-фуранил)метилен]амино]— оксазолидин-2-он
Таблетки по 50 мг.
НИФУРОКСАЗИД
(NIFUROXAZIDE)
|
N N |
O |
O2N O |
|
|
|
H |
OH |
|
|
1-(4-гидроксибензоил)-2-[(5- нитрофуран-2-ил)метилен]диазан
Таблетки ПО по 100 мг; суспензия для внутреннего применения 220 мг/5 мл
Лекции по фармацевтической химии
НИФУРАТЕЛ
(NIFURATEL)
МАКМИРОР
O2N O |
N N |
S |
|
|
O |
|
O |
|
CH3
5-[(метилтио)метил]-3-{[(1E)-(5-нитро- 2-фурил)метилен]амино}-1,3- оксазолидин-2-он
Таблетки ПО по 200 мг; МАКМИРОР КОМПЛЕКС (с нистатином): крем вагинальный (на 30 г - 3 г + 1200000 ЕД), суппозитории
вагинальные 500 мг+200000 ЕД).
ПРИМЕРЫ СИНТЕЗА НИТРОФУРАНОВ
Исходным веществом для синтеза нитрофуранов - |
Нитрофурантоин |
O |
|
|
|
|
|
O |
|
||||||||||
|
OH |
|
|
|
|
|
|||||||||||||
фурфурол, получаемый из пентозансодержащего сырья |
|
|
|
|
|
H2SO4 |
|
|
|
NH + H2O |
|||||||||
(кукурузные початки, овсяная и рисовая шелуха и т.д.) |
|
|
|
H2N N |
|
NH2 |
98-100 |
°C |
H2N |
N |
|||||||||
действием разбавленных минеральных кислот. |
|
|
|
O |
|
O |
|
||||||||||||
|
|
|
|
+ |
|
|
|
2-семикарбазидуксусная |
|
|
|
|
|
|
|||||
|
|
(C5H8O4)n + nH2O H |
nC5H10O5 |
|
|
|
кислота |
|
O |
|
1-амино-2,4-имидазолидиндион |
||||||||
|
|
|
|
|
|
|
|
|
|
O |
+ |
|
|
|
|
|
|
N N |
O |
|
|
C5H10O5 |
O |
O + 3H2O |
|
O2N O |
|
H2N N NH |
O2N O |
|
+ H2O |
||||||||
|
|
|
|
H |
|
|
|
|
H |
|
O |
|
|
|
|
|
|
NH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
||
При нитровании фурфурола в мягких условиях |
Фуразолидон |
|
|
|
|
|
|
|
|
||||||||||
(ацидофобность!) получают 5-нитрофурфурол: |
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
O |
HNO3, (CH3COO)2O |
|
OCOCH3 |
|
|
|
O + |
|
|
|
|
|
|
|
|
||
|
O |
пиридин |
O2N |
O |
|
|
|
N |
O |
|
|
|
N |
+ H2O |
|||||
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
H |
|
|
|
|
OCOCH3 |
O2N |
O |
H |
H2N |
|
O |
O2N |
|
O |
|
N |
O |
|
|
|
|
H2SO4 |
|
|
|
|
|
|
|
|
|
|
|
|
|||
O2N |
|
|
OCOCH3 |
|
|
O |
|
|
|
3-амино-2-оксазолидинон |
|
|
|
O |
|
||||
O |
|
95-98 °C O2N |
O |
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
OCOCH3 |
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2011/2012 |
|
|
|
|
|
|
|
|
|
|
|
|
7

Жерносек А.К. Лекции по фармацевтической химии
Нифурател |
|
OH N2H4 H3C S |
диэтилкарбонат |
|||||||
O |
CH3SH H3C S |
OH |
(C2H5O)2CO |
|||||||
Cl |
|
|
|
Cl |
|
NH |
|
|
|
|
эпихлоргидрин |
|
|
|
|
|
|
|
|
||
|
CH3 |
|
|
|
NH2 |
|
|
|
||
H2N |
S |
|
O |
|
|
|
CH3 |
|||
O2N |
O |
|
|
N N |
|
|
S |
|||
N |
O |
|
|
H O2N |
O |
|
O |
|
||
O 3-амино-5-(метилтиометил)-2-оксазолидон |
|
|
|
|
||||||
O |
|
|
|
|
||||||
Нифуроксазид |
|
|
|
|
|
|
|
|
||
O |
|
|
|
|
|
|
|
|
||
|
|
|
H2N |
O |
O2N |
|
O |
|
O |
|
|
H3CO |
|
|
N |
|
H |
|
|||
|
|
|
|
|
|
|
||||
|
|
N2H4 |
|
|
|
|
||||
|
|
|
|
OH |
H |
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
метил 4-гидроксибензоат |
|
O |
|
|
|
|
|||
|
|
|
|
O2N |
O |
N N |
|
|
|
|
|
|
|
|
|
|
H |
|
|
OH |
|
|
|
|
|
|
|
|
|
|
||
МЕТОДЫ КОНТРОЛЯ КАЧЕСТВА НИТРОФУРАНОВ
Характеристика веществ
Нитрофурал* Нитрофурантоин Фуразолидон Нифуроксазид
|
Жёлтый или |
ЖКП либо жёлтые |
ЖКП |
Ярко-жёлтый КП |
||||
|
коричневато-Ж. кристаллы, без |
|
|
|
||||
|
КП |
запаха либо почти |
|
|
|
|||
|
|
|
без запаха |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
Нитрофурал |
Н-фурантоин |
Фуразолидон |
Нифуроксазид |
|||
|
Вода |
|
ОМ |
|
ОМ |
ОМ |
|
ПрН |
|
EtOH |
|
М |
|
ОМ |
ОМ |
|
М |
|
Эфир |
|
|
|
|
ПрН |
|
|
|
CHCl3 |
|
|
|
|
М |
|
|
|
CH2Cl2 |
|
|
|
|
|
|
ПрН |
|
ДМФА |
|
|
|
Р |
|
|
|
*Приведен для сравнения. Подробно фармакопейный анализ нитрофурала
(фурацилина) изучался на 3 курсе!
Спектры поглощения в УФ-области
A |
|
|
В диапазоне 220–400 нм спектры |
|||
|
Фуразолидон |
|||||
|
поглощения производных 5-НФ |
|||||
|
|
|
||||
|
|
|
имеют две полосы поглощения: |
|||
|
|
|
длинноволновую с максимумом в |
|||
|
|
|
области 365–375 нм и менее |
|||
|
|
|
интенсивную коротковолновую с |
|||
|
|
|
максимумом при 260–270 нм. |
|||
200 |
300 |
400 , нм |
|
|
|
|
|
ЛС |
Среда |
|
Интер., нм |
Максимумы (УПП), нм |
|
Нитрофурал |
ДМФА + W |
220-400 |
375 и 260 (отношение |
|
||
|
|
|
|
|
А 1,15-1,30) |
|
Нитрофурантоин |
ДМФА + |
|
220-400 |
367 и 266 (отношение |
|
|
|
|
ацетат. БР |
|
А 1,36-1,42) |
|
|
Фуразолидон |
ДМФА + W |
250-400 |
367 (750) и 260 |
|
||
Идентификация
Нитрофурал |
Нитрофурантоин |
Фуразолидон |
Нифуроксазид |
|
ИК-спектрометрия |
|
|
УФ |
УФ |
|
|
ТСХ |
|
|
|
+ ДМФА, + |
+ ДМФА, + KOH |
+ ДМФА, + KOH |
|
KOH (спирт.) – |
(спирт.) – |
(спирт.) – |
|
фиолетово- |
фиолетово- |
фиолетово- |
|
красное |
красное |
красное |
|
|
|
|
O |
O N |
|
N N |
OH- |
O |
NH2 |
||
O |
|
H |
O |

 O N
O N
 O
O
 N N
N N
 NH2
NH2
O
Чистота
|
Нитрофурал |
Н-фурант |
Фуразолидон |
Нифуроксазид |
К или |
рН = 5,0-7,0 |
|
рН = 4,5-7,0 |
|
Щ |
(W, 1%) |
|
(W, 1%) |
|
СПр |
ВЭЖХ |
ТСХ |
|
ВЭЖХ |
ТМ |
|
|
|
+ |
m |
+ |
н.б. 1% |
+ |
+ |
CЗ |
+ |
+ |
+ |
+ |
ОКОР, |
+ |
+ |
+ |
|
МЧ |
|
|
|
|
+ more |
|
|
Tпл 257-259 С |
УПП при 367 нм |
|
|
|
Нитрофураля |
Примесь п- |
|
|
|
диацетат - ТСХ |
гидроксибензо- |
|
|
|
|
гидразида – |
|
|
|
|
фотометрия с |
|
|
|
|
фосф.-вольф.к |
2011/2012
8

Жерносек А.К. Лекции по фармацевтической химии
Количественное определение
ЛС |
Метод |
Нитрофурал |
Спектрофотометрия (ДМФА + вода, |
|
375 нм, по сравнению с ФСО). |
Нитрофурантоин Спектрофотометрия (ДМФА + ацетатный БР; 367 нм; УПП = 375). Таблетки – аналогично.
Фуразолидон Спектрофотометрия (ДМФА + вода, 367 нм, УПП = 750).
Нифуроксазид Алкалиметрия (ДМФА + вода; 0,1 М NaOH; потенц. КТТ; 1:1).
НИТРОИМИДАЗОЛЫ
Группа противомикробных ЛС, являющихся производными 2-метил-5-нитроимидазола:
N
H3C 2
 N
N 5 NO2
5 NO2
R
Влияют на МО, восстанавливающие нитрогруппу (большинство анаэробов, многие простейшие). Образующиеся токсичные продукты нарушают репликацию ДНК, синтез белка, угнетают тканевое дыхание:
R NO2 + e  R NO2
R NO2
N
H3C N
N
 NO2
NO2
OH
Метронидазол
N
H3C N
N
 NO2
NO2

 Cl
Cl
OH
Орнидазол
|
N |
H3C |
NO2 |
N O O |

 S
S
 CH3
CH3
Тинидазол
Используют при трихомониазе, лямблиозе, амебиазе; инфекциях, вызванные анаэробными бактериями, смешанных аэробноанаэробные инфекции (в комбинации с антибиотиками),
эрадикации Helicobacter pylori (в
комбинации с ЛС висмута и антибиотиками).
МЕТРОНИДАЗОЛ
(METRONIDAZOLE)
КЛИОН
N МЕТРОГИЛ H3C
 N
N
 NO2 ТРИХОПОЛ
NO2 ТРИХОПОЛ
OH
2-(2-метил-5-нитро-1-H-
имидазол-1-ил)этанол
Таблетки ПО по 250 и 500 мг; таблетки по 250 мг; суппозитории вагинальные по 100 и 500 мг; раствор для инфузий 0,5%; гель 1%.
ТИНИДАЗОЛ
(TINIDAZOLE)
|
N |
H3C |
NO2 |
N O O |

 S
S
 CH3
CH3
1-[2-(этилсульфонил)этил]-2-метил-5-нитро-1H-имидазол
Таблетки ПО по 500 мг.
ОРНИДАЗОЛ
(ORNIDAZOLE)
ТИБЕРАЛ N ДАЗОЛИК
H3C N
N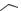
 NO2
NO2

 Cl
Cl
OH
3-(2-метил-5-нитро-1H-имидазол-1- ил)-1-хлорпропанол-2
Таблетки ПО по 500 мг.
2011/2012
9
Жерносек А.К. Лекции по фармацевтической химии
ПРИМЕРЫ СИНТЕЗА НИТРОИМИДАЗОЛОВ
|
N |
HNO3 |
|
N |
|
|
O |
|
|
N |
Метронидазол |
||||
H3C |
|
H C |
|
NO |
|
H |
C |
|
NO |
|
|
|
|||
N |
|
N |
2 |
|
|
N |
2 |
|
|
||||||
|
|
3 |
|
|
|
3 |
|
|
|
|
|||||
|
H |
|
|
H |
|
|
|
|
|
|
|
OH |
|
|
|
2-метилимидазол |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
O O |
2-(этилсульфонил)этанол |
O O |
|
O O |
|
N |
|
||||||
|
|
|
OH O O |
|
|
|
|
|
|
|
|||||
|
|
S Cl |
S CH3 |
|
|
S |
O |
|
S |
CH3H3C |
N |
NO2 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
H3C |
|
|
|
H3C |
N |
|
|
|
|
|
|
|
|
|
|
4-метилбензолсульфонилхлорид |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
NO2 |
|
Тинидазол |
|
|||||||||
|
|
|
|
H3C |
N |
|
|
|
|||||||
|
|
|
|
O O |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
S |
|
CH3 |
|
|
|
|
|
Орнидазол |
|
N |
|
|
|
N |
|
|
|
|
N |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
SO2 H3C |
N |
NO2 |
|
|
|
|
|
|
||||
Cl |
|
O |
|
|
N |
|
NO2 |
HCl H3C |
N |
NO2 |
|||||
|
|
H |
|
H3C |
|
|
|||||||||
|
|
OH |
2 |
NaOH |
|
|
|
|
|
|
O |
|
|
|
Cl |
бис(3-хлор-2-гидроксипропил)сульфат |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
OH |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
МЕТОДЫ КОНТРОЛЯ КАЧЕСТВА НИТРОИМИДАЗОЛОВ
|
|
|
|
|
|
ЛС |
Метронидазол |
Тинидазол |
|
|
Вн.вид |
Б. или желтоватый КП |
Почти Б. или бл. Ж. КП |
|
|
Раствор. |
W – М, EtOH – М, ацетон – |
W – ПрН, МеOH – У, |
|
|
|
М, CH2Cl2 - М |
ацетон – Р, CH2Cl2 - Р |
|
|
Идент. |
ИК |
ИК |
|
|
|
УФ (0,1 М HCl, 230-350 нм, |
УФ (MeOH, 230-350 нм, |
|
|
|
макс – 277 (УПП 365-395), |
макс – 310 (УПП 340- |
|
|
|
мин – 240 нм. |
360). |
|
|
|
Tпл 159-163 ºС. |
Tпл 125-128 ºС. |
|
|
|
Восст. –NO2 и на ПАА |
Восст. –NO2 и на ПАА |
|
|
Чистота |
П и Ц, СПр (ВЭЖХ), ТМ, СЗ, |
П и Ц, СПр (ТСХ), ТМ, |
|
|
|
m, ОКОР, МЧ |
СЗ, m |
|
|
КО |
Ацидиметрия (б/в. AcOH; |
Ацидиметрия (б/в. AcOH; |
|
|
|
0,1 M HClO4; потенц.) |
0,1 M HClO4; потенц.) |
|
|
|
Гель – ВЭЖХ (С18; MeOH – |
|
|
|
|
р-р KH2PO4 (pH 4); 240 нм) |
|
|
|
|
РДИнф – СФМ, 0,1 М HCl; |
|
|
|
|
277 нм, УПП = 375; |
|
|
|
|
Таблетки – ацидиметрия. |
|
|
|
|
|
|
|
Орнидазола в Ph.Eur, BP, USP, ГФ РБ и др. нет! Тем не менее …
От белого до светло-жёлтого КП, практически без запаха. Растворимость (мг/мл): W – 17,3; EtOH (95%) – 709; CH2Cl2 – 432; гексан – 0,0155.
Идентификация: ИК (характерные пики при 3174, 1537, 1361, 1270 см-1).
УФ (раствор в i-PrOH – максимумы при 230 и 311 нм). Восстановление нитрогруппы и реакция на ПАА.
Количественное определение: ацидиметрическое титрование.
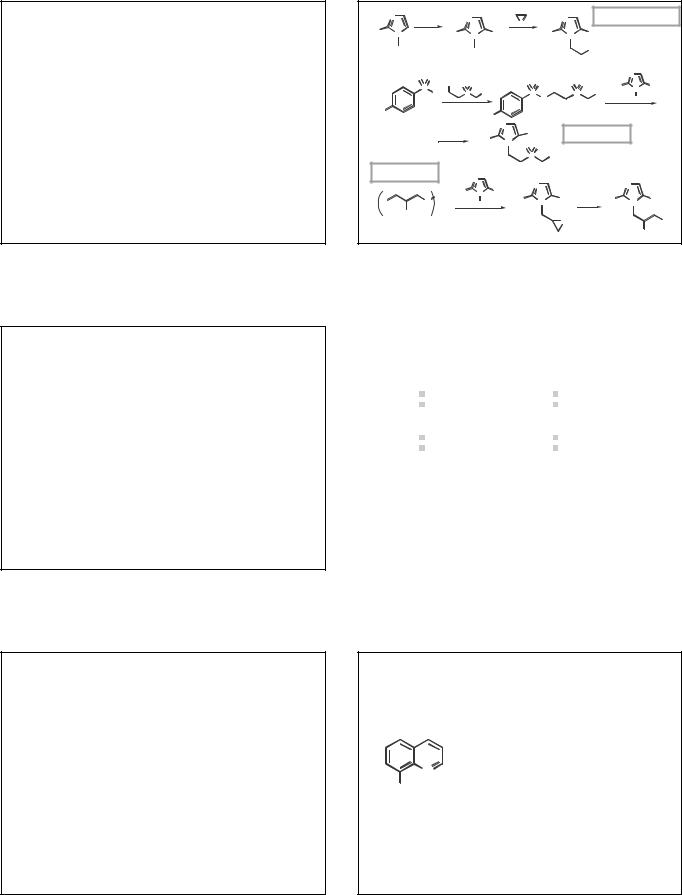
ПРОИЗВОДНЫЕ 8-ГИДРОКСИХИНОЛИНА
Группа ЛС, в основе которых лежит структура:
8-гидроксихинолин (8-хинолинол)
8 
 N
N
OH
Обладают антибактериальным, противогрибковым и противопаразитарным действие. Противомикробное действие обусловлено способностью образовывать хелаты с катионами металлов.
2011/2012
10
