
- •Чернівці - 2012
- •Тема 4: Колігативні властивоcті розчинів
- •Тривалість заняття: 2 години
- •Вміти: проводити розрахунки на основі законів Рауля та Вант-Гоффа для розчинів електролітів та неелектролітів
- •Поради студенту
- •Теоретичні відомості з теми
- •Визначення осмотичної резистентності еритроцитів (стійкості до гемолізу)
- •Матеріали для самоконтролю
- •NNaOH VNaOH
- •Перший закон термодинаміки
- •Ентальпія
- •Теплові ефекти хімічних реакцій
- •Закон Гесса
- •ІІ закон термодинаміки. Ентропія
- •Ізобарно-ізотермічний потенціал (енергія Гіббса)
- •Порядок i молекулярнiсть реакції
- •Особливості біологічних каталізаторів
- •Інструкція для лабораторно-практичної роботи
- •Вплив температури на швидкість реакції розкладу натрію тіосульфату
- •Матеріали для самоконтролю. Завдання
- •Хімічна рівновага
- •Інструкція для лабораторно-практичної роботи
- •Визначення потенціалів окремих електродів
- •Матеріали для самоконтролю. Тести
- •Інструкція для лабораторно-практичної роботи
- •Йонно-обмінна адсорбція сульфосаліцилату натрію на Н-катіоніті
- •Матеріали для самоконтролю.Завдання.
- •Інструкція для лабораторно-практичної роботи
- •Визначення ІЕТ желатину за мінімумом в’язкості.
- •Матеріали для самоконтролю. Тести

папері, утворюють пляму, центральна частина якої забарвлена, а периферія безбарвна. Якщо ж гранула негативна, то золь не адсорбується папером і утворює рівномірно забарвлену пляму.
3. Визначення порогу коагуляції золю гідроксиду заліза(III). Дня визначення порогу коагуляції в колбу для титрування відбирають піпеткою 5,00 мл досліджуваного золю і титрують розчином електроліту до появи слабкого помутніння. Поріг коагуляції розраховують за формулою:
Cпорог. Сел ту Vел ту 1000
[ммоль/л]
Матеріали для самоконтролю.Завдання.
1.Який об’єм 0,0050 н розчину барію хлориду треба додати до 20 мл 0,0010 н розчину сірчаної кислоти, щоб одержати золь барію сульфату з позитивною гранулою? Напишіть міцелярну формулу.
2.Що визначає стійкість ліофобних золей? Який заряд матимуть гранули золю аргентум йодиду, одержаного змішуванням 10 мл 0,010 н розчину калію йодиду і 15 мл 0,005 н розчину аргентум нітрату. Напишіть рівняння реакції і формулу міцели.
3.Напишіть формулу міцели золю, одержаного амідуванням барію хлориду і сірчаної кислоти, якщо кислота взята у надлишку. Який
з електролітів: КСl, МgSО4 чи Аl2(SО4)3 буде мати менший поріг коагуляції і більшу коагулювальну здатність?
4.При якій напруженості електричного поля велись дослідження, якщо швидкість електрофорезу склала 5,3.10-6 м/с, середовищем була вода з діелектричною проникністю 81 і в'язкістю 1 10-3 Н с/м.-потенціал гранули дорівнює 34 мВ.
5.Знайти поріг коагуляції золю аргентум йодиду (в ммоль/л), якщо для коагуляції 15 мл золю необхідно 0,8 мл 0,04 М розчину магнію хлориду.
6.На 100 мл стічних вод для коагуляції колоїдних частинок необхідно 1 мл 5М розчину натрій хлориду. Визначити поріг коагуляції (в ммоль/л).
Зразок білету для кінцевого контролю знань студентів
|
1. Знайдіть відповідність. |
|
|
||
1 |
Коагуляція |
A. |
процес |
злипання |
частинок дисперсної |
|
|
|
фази. |
|
|
2 |
Седиментація |
B. процес подрібнення частинок дисперсної |
|||
|
|
|
фази. |
|
|
3 |
Диспергування |
C. |
осідання |
частинок |
дисперсної фази під |
дією сили тяжіння.
4 Дифузія D. вирівнювання концентрації золю по всьому об’єму золю.
E.процес дезагрегації частинок осаду.
2.Як називають явище зниження порогу коагуляції золю при додаванні до них ВМС?
А. Колоїдний захист. В. Сенсибілізація.
С. Коагуляція.
D. Bзаємна коагуляція. Е. Дифузія.
3.Який електроліт проявляє найвищу коагулювальну дію на золь Fe(OH)3, одержаний гідролізом?
A.KCl
B.K2SO4
C.BaCl2
D.K3[Fe(CN)6]
E.NaCI
4.Які з наведених явищ належать до електрокінетичних?
A.Коагуляція.
B.Седиментація.
C.Електрофорез.
D.Електроосмос.
E.Дифузія.
5.Який з приведених електролітів має найбільшу коагулювальну дію для золю барію сульфату з позитивною гранулою?
A.NaNO3;
B.K2SO4;
C.AlCl3;
D.K4[Fe(CN)6]
E.КСІ
6. Молекули яких речовин здійснюють у крові колоїдний захист?
A.Білків.
B.Жирів.
C.Холестерину.
D.Вуглеводів.
E.Вуглеводнів.
7.Обчислити масу лікарського препарату кальцію глюконату, що міститься у водному розчині, якщо на титрування фільтрату, що
утворився при пропусканні розчину через катіоніт у Н+-формі, витратилось 15 мл 0,1 М розчину. Відносна молекулярна маса кальцію глюконату становить 430.
РЕКОМЕНДОВАНА ЛІТЕРАТУРА
Основна: Мороз А.С. Медична хімія /А.С.Мороз, Д.Д.Луцевич, Л.П.Яворська. – Вінниця: Нова книга. – 2006. – С. 603-674.
Додаткова: Мороз А.С. Біофізична та колоїдна хімія /А.С.Мороз, Л.П.Яворська, Д.Д.Луцевич та ін. – Вінниця: Нова книга, 2007.-С.395- 475.
ТЕМА 13. ВЛАСТИВОСТІ РОЗЧИНІВ БІОПОЛІМЕРІВ.
ІЗОЕЛЕКТРИЧНА ТОЧКА БІЛКА
АКТУАЛЬНІСТЬ ТЕМИ. До найважливіших біополімерів, що є в організмі людини і тварин, відносять білки, вуглеводи, нуклеїнові кислоти, складні пептиди. Вони утворюються в процесі біосинтезу в клітинах і каталізують й регулюють біохімічні реакції (ферменти, гормони), зберігають і передають генетичну інформацію (ДНК), виконують структурну, опорну функції (колаген, фіброїн, кератин).
Синтетичні полімери широко застосовують при протезуванні (штучні шлуночки, стимулятори серця), виготовленні медичних пристосувань (шовний матеріал, тканинні клеї), лікарських засобів (кровота плазмозамінники), мембран для гемодіалізу. Тому вивчення структури і фізико-хімічних властивостей високомолекулярних сполук необхідне для пізнання важливих біохімічних процесів.
ТРИВАЛІСТЬ ЗАНЯТТЯ: 2 год
НАВЧАЛЬНІ ЦІЛІ ЗАНЯТТЯ. Студент повинен:
класифікувати високомолекулярні сполуки за типом мономерних ланок, за просторовою будовою
оцінювати властивості високомолекулярних сполук на основі хімічного складу та просторової будови макромолекул
характеризувати колігативні властивості розчинів високомолекулярних сполук та значення їх в життєдіяльності
характеризувати стійкість розчинів високомолекулярних сполук та вплив різних чинників на коагуляцію, коацервація, пептизацію тощо
трактувати поняття ізоелектричний стан та ізоелектрична точка біополімерів
ПОРАДИ СТУДЕНТУ
Підготуйте питання до практичного заняття і виконайте вказівки до них.
Питання |
|
Вказівка |
|
|
ВМС – основа живих |
Див. |
методрозробку |
для |
СРС |
орга-нізмів. Глобулярна |
«Високомолекулярні сполуки» |
|
||
та фіб-рилярна |
|
|
|
|
структура білку |
|
|
|
|
Порівняльна характерис- |
З’ясуйте подібні та відмінні |
|
||
тика розчинів ВМС і НМС |
характеристики ВМС та НМС |
|
||
Питання |
|
Вказівка |
|
|
|
|
|||
Ізоелектричний стан |
З’ясуйте, чому білок не рухається і |
|||
біл-ку. Ізоелектрична |
електричному полі в ізоелектричній |
|||
точка |
точці. |
|
|
|
Набухання та |
Зверніть увагу на механізм набухання, |
|||
розчинення полімерів |
та як впливає рН |
|
|
|
|
середовища, температура, наявність |
|||
|
електролітів на цей процес |
|
|
|
Роль набухання в |
Див. методрозробку для СРС «Роль |
|||
фізіології організму |
набухання в фізіології організму» |
|
||
Драглювання розчинів |
Зауважте на механізм драглювання та |
|||
ВМС |
вплив чинників на швидкість |
|
||
|
драглювання |
|
|
|
Тиксотропія. Синерезис |
Наведіть приклади з побуту вказаних |
|||
|
явищ |
|
|
|
Висолювання |
Наведіть приклади речовин, якими |
|||
біополімерів з розчинів |
можна провести висолювання |
|
||
|
біополімерів з розчинів |
|
|
|
Коацервація та її роль в |
Наведіть приклади коацервація в |
|
||
біологічних системах |
біологічних системах |
|
|
|
Аномальна в’язкість |
З’ясуйте, чим зумовлена підвищена |
|||
розчинів ВМС |
в’язкість розчинів ВМС |
|
|
|
Осмотичний тиск роз- |
З’ясуйте, чому осмотичний тиск |
|
||
чинів ВМС. Онкотичний |
розчинів біополімерів нижчий, ніж |
|||
тиск плазми крові. Роль |
НМС. |
|
|
|
осмосу в біологічних |
Запам’ятайте величину онкотичного |
|||
системах |
тиску плазми крові. Наведіть конкретні |
|||
|
приклади стосовно ролі осмосу для |
|||
|
біологічних систем |
|
|
|

Теоретичні відомості з теми Класифікація високомолекулярних сполук
Ви со ко мо ле ку ляр ни ми сп о л ука ми (ВМС) називають речовини складної хімічної будови з молекулярною масою порядку 104-106 атомних одиниць маси. Структурною одиницею ВМС є макромолекула, що складається з великого числа окремих груп атомів (елементарна ланка), зв’язаних між собою ковалентними хімічними зв’язками. Класифікація ВМС подана в таблиці 21.
Табл.21. Класифікація високомолекулярних сполук
Класиці- |
|
Шляхи одержання, |
|
|
||||
каційна |
Групи |
Приклади |
||||||
характеристика |
||||||||
ознака |
|
|
|
|||||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|||
|
Природні |
Утворюються |
в |
Білки, |
НК, |
|||
|
процесі біосинтезу |
поліцукри |
||||||
|
|
|||||||
За поход- |
Штучні |
У результаті обробки |
Похідні целюлози |
|||||
женням |
природних полімерів |
|
|
|||||
|
|
|
||||||
|
Синтетичні |
Реакції |
полімеризації |
Поліетилен, капрон, |
||||
|
чи поліконденсації |
найлон |
|
|||||
|
|
|
||||||
|
Лінійні |
Мають довгі ланцюги |
Поліетилен,амілоза |
|||||
|
|
Атомні угруповання в |
Глікоген, |
|||||
|
|
макромолекулах розта- |
амілопектин |
|||||
За |
Розгалужені |
шовуються у формі |
крохмалю |
|||||
структурою |
|
довгого ланцюга з |
|
|
||||
полімерного |
|
відгалуженнями |
|
|
||||
ланцюга |
|
Ланцюги з’єднані між |
Фенол, |
целюлоза, |
||||
|
Сітчасті |
со-бою поперечними |
формальдегідна |
|||||
|
хімічни-ми зв’язками у |
смола, |
|
|||||
|
|
|
||||||
|
|
вигляді сітки |
|
|
|
|||
|
|
Молекули |
|
згорнуті |
Альбуміни, гло- |
|||
|
|
під дією сил внутріш- |
буліни яєчного бі- |
|||||
|
Глобулярні |
ньо |
молекулярної |
лку, молока, сиро- |
||||
За формою |
|
взаємодії |
у сферичні |
ватки крові, гемо- |
||||
макро- |
|
клубки - глобули |
глобін крові |
|||||
молекул |
|
Слабо |
|
розгалужені |
Міозин, |
кератин, |
||
|
Фібрилярні |
ланцюги |
|
молекул, |
колаген, |
еластин, |
||
|
орієнтовані в |
одному |
фіброїн |
|
||||
|
|
|
||||||
|
|
напрямку, |
утворюють |
|
|
|||
|
|
структури - фібрили |
|
||
|
Карбо- |
Полімерні ланцюги |
Бутадієновий |
||
|
ланцюгові |
містять тільки атоми С |
каучук |
||
|
|
Полімерні ланцюги міс- |
Лавсан |
||
За |
Гетеро- |
тять атоми |
Карбону, |
|
|
ланцюгові |
Оксигену, |
Нітрогену, |
|
||
хімічною |
|
||||
|
Сульфуру, Фосфору |
|
|||
природою |
|
|
|||
|
Полімерні |
ланцюги |
Полісилоксани |
||
атомів |
Елемент- |
||||
макромолекул містять |
|
||||
|
органічні |
|
|||
|
атоми Si, B, Al |
|
|||
|
|
|
|||
|
Неорганічні |
Полімери, що не міс- |
Кремнезем, кварц, |
||
|
|
тять атомів Карбону |
цеоліти |
||
Природні ВМС утворюються в процесі біосинтезу, починаючи від СО2, Н2О, N2 через проміжні продукти метаболізму у мононуклеотиди, амінокислоти, прості цукри, жирні кислоти, з яких утворюються макромолекули - НК, білки, полісахариди, ліпіди.
Ускладнення макромолекул у надмолекулярні системи (ферментні комплекси, рибосоми, скорочувальні системи), а потім органели клітин (ядро, мітохондрії, хлоропласти) відбувається за допомогою нековалентних зв’язків. Тобто розвиток молекул у клітинах живих організмів відбувається за принципом «від простого до складного». Високоорганізовані організми одержують сполуки Карбону вже з готових будівельних блоків, які засвоюються, а при потребі розщеплюються на молекули, необхідні для метаболічних реакцій.
Природні ВМС одержують екстракцією і фракційним осадженням з природної сировини; синтетичні – р еа кц ія ми п о лі мер и за ц і ї (реакція сполучення мономерів за рахунок розриву кратних зв’язків без зміни елементного складу і виділення побічних продуктів) та п о л іко нде нса ц і ї (реакція сполучення мономерів з двома та більше функціональними групами з виленням низькомолекулярного побічного продукту). Полімеризацією одержують полівінілхлорид, тефлон; поліконденсацією – лавсан, капрон, енант.
ХАРАКТЕРИСТИКА РОЗЧНІВ ВИСОКОМОЛЕКУЛЯРНИХ СПОЛУК
Фізико-хімічні властивості. 1. Висока еластичність –еластин (стінка артерій), абдиктин. 2 Морозостійкість. 3. Пластичність. 4. Гнучкістьзалежить від довжини сегмента. Так, внаслідок гнучкості ланцюгів молекули ДНК, довжина яких досягає кількох сантиметрів, можуть пакуватися і зберігатися у ядрі клітини розміром 10-6м. Тільки
полімери з гнучкими макромолекулами здатні до великих оборотних деформацій. Саме остання властивість більшою мірою відрізняє ВМС від НМС. 5. Дуалізм властивостей – властивість полімерів орієнтуватись під дією навантаження і при цьому зміцнюватись. Тому повздовжня міцність полімерних ниток близька до міцності твердого тіла, а властивості ниток у поперечному напрямку наближаються до властивостей рідин. 6. Велика механічна міцність (колагени – група волокнистих білків, є компонентами сухожиль, зв’язок).
Загальні властивості. Розчини ВМС проявляють властивості істинних розчинів та колоїдних.
Таблиця. 22. Загальні властивості ВМС
Властивість |
Істинні |
ВМС |
|
Колоїдні |
||
|
|
|
|
|
||
Термодинамічна |
Термодина |
Термодинамічно |
Нестійкі |
без |
||
стійкість |
мічно стійкі |
стійкі |
|
|
стабілізатора |
|
Дисперсність |
Гомогенні |
Гомогенні |
|
Гетерогенні |
|
|
Швидкість дифузії |
Швидка |
Повільна |
|
|
Повільна |
|
Оптичні |
Оптично |
Розсіюють світло |
Розсіюють світло |
|||
властивості |
пусті |
|
|
|
|
|
Електрокінетичні |
- |
Мають |
здатніть |
Мають здатність |
||
властивості |
|
до електрофорезу |
до електрофорезу |
|||
Структуро- |
- |
Переходять |
в |
Переходять |
в |
|
утворення |
|
напівтверді |
|
напівтверді |
|
|
|
|
системи-драглі |
|
системи-гелі |
||
Специфічні |
Не в’язкі, |
Велика в’язкість. |
Велика в’язкість. |
|||
|
високий ос- |
Малий |
осмо- |
Малий |
осмо- |
|
|
мотичний |
тичний тиск |
|
тичний тиск |
|
|
|
тиск |
|
|
|
|
|
Термодинамічна стійкість. Розчини ВМС є термодинамічно стійкими. Стійкість їх обумовлена:
а) наявністю гідратної оболонки (сольватної). Гідрофільність природних ВМС обумовлена присутністю в молекулі великого числа йоногенних груп -СООН, -NН2, >С=О; -ОН; -SН, та інших, до яких притягуються полярні молекули води, утворюючи навколо них суцільну гідратну оболонку, яка стабілізує молекулу ВМС;
б) електричним зарядом, який виникає в результаті йонізації функціональних груп молекул ВМС. Для руйнування цих систем необхідно зменшити спорідненість ВМС до розчинника шляхом
послаблення або видалення сольватних (гідратних) оболонок. Це можна зробити, додавши десольватуючих реагентів, наприклад електролітів. При додаванні електролітів до розчину ВМС відбувається десольватація макромолекул, зменшення їх розчинності і виділення останніх з розчину - в и с о л ю в а н н я . Механізм висолювання полягає в тому, що йони солей притягують до себе молекули води (розчиника), зменшуючи цим самим кількість води яка взаємодіє з полімером. А оскільки розчинність білків залежить від утворення гідратної оболонки навколо йоногенних груп, то переміщення їх до йонів солей знижує розчинність білка і він випадає в осад.
Найкраще висолювання білків іде в ІЕТ. Застосовуючи розчини солей різної концентрації, можна послідовно розділити білки на фракції: спочатку осідають білки з великою молекулярною масою і т.д., при великих концентраціях солей - осідають найлегші фракції. Висолювання з водних розчинів можна проводити органічними розчинниками (ацетон, етанол та інші), які добре гідратуються.
Процес висолювання відрізняється від колоїдних розчинів: а) висолювання процес зворотний; б) для висолювання потрібна велика концентрація електроліту;
в) причина висолювання полягає в зниженні розчинності полімеру внаслідок його десольватації, а причина коагуляції - в зменшенні розклинюючого тиску між колоїдними частинками.
Висолювальна дія не зв’язана однозначно з зарядом йону, а визначається його дегідратуючою здатністю. Висолювальна дія йона тим більша, чим більший ступінь його гідратації.
Збільшення висолювальної дії спостерігається в рядах:
для аніонів: C2O42– > SO42– > CH3COO– > Cl– > CNS–
для катіонів: Li+ > Na+ > K+ > Cs+
Основне значення у висолюванні, належить аніонам. Менший висолювальний ефект мають катіони. Ці ряди називають ліотропними рядами Гофмейстера.
Електрокінетичні властивості розчинів ВМС. Як і в колоїдних розчинах, в розчинах ВМС - поліелектролітів може відбуватись електрофорез і електроосмос. Це обумовлено тим, що частинки таких ВМС мають електричний заряд і тому здатні рухатися в електричному полі.
Електрофорез білків виражається в русі електрично заряджених частинок білка в електричному полі. При електрофорезі досліджувану суміш білків поміщають в буферний розчин, який контактує з електродами.

Швидкість руху досліджуваної частинки в електричному полі залежить від розміру глобул і величини заряду, тому не є однаковою для всіх частинок.
V K EZ E
Е - діелектрична стала; - вязкість; Z - дзета потенціал; К - константа (часто рівна від 1/4 до1/6 .
Величину швидкості при напруженості – 1 в/см називають
е л е к т р о фо р е ти чно ю р ухли ві стю бі лка . Білки розділяють на основі їх різної електрофоретичної рухливості. Багато захворювань характеризується зміною співвідношення різних білків в плазмі крові, що дозволяє використати метод електрофорезу в діагностиці, контролі за протіканням хвороби.
ДРАГЛЮВАННЯ РОЗЧИНІВ ВИСОКОМОЛЕКУЛЯРНИХ СПОЛУК
Розчини ВМС, як і золі гідрофобних колоїдних систем, здатні при певних умовах втрачати текучість і переходити в гелі (драглі). Є два способи одержання гелів: 1) драглювання розчинів ВМС; 2) обмежене набухання полімеру в розчиннику.
Процес переходу розчину ВМС в драглі супроводжується утворенням просторової сітки по всьому об’єму за рахунок взаємодії між макромолекулами. Основним видом взаємодії є взаємодія гідрофобних і полярних ділянок макромолекули, йоногенних і йонізованих груп, а також утворення водневих зв’язків. Можуть виникати також хімічні зв’язки, наприклад, при вулканізації каучуку.
Драглювання нагадує процес коагуляції колоїдних систем, але при драглюванні система не розділяється на рідку і тверду фазу. Розчинник повністю залишається в системі. Процес драглювання залежить від наступних чинників: розміру, форми та природи макромолекул, концентрації дисперсної фази, температури, часу, наявності електролітів, рН розчину і т.д. Чим концентрованіший розчин, тим ймовірна взаємодія між активними центрами макромолекул.
Підвищення температури перешкоджає драглюванню через зростання мікроброунівського руху частинок макромолекул і послаблення взаємодії між ними. Пониження температури, як правило, сприяє драглюванню. Найкраще драглювання йде при рН близьких до ІЕТ, тому що сумарний заряд молекул мінімальний (близько 0), що полегшує виникнення між ними зв’язків різної природи.
Драглі мають властивості твердих тіл та рідин:
а) зберігати форму, еластичність, гнучкість (як тверді тіла); б) дифузія, висока електропровідність, відносно велика швидкість
хімічних реакцій (як рідини).
Драглі мають специфічні властивості:
а) тексотронність- здатність гелів оборотно переходити при збовтуванні, перемішуванні в розчин і повертатись у стані спокою в драглі; б) синерезис - самовільне виділення з драглю розчинника у вигляді окремої рідкої фази. Сам гель зменшується в об’ємі.Синерезис має місце в живих організмах (м’ясо молодих тварин соковитіше, ніж старих).
НАБУХАННЯ ПОЛІМЕРІВ ТА РОЗЧИНЕННЯ ПОЛІМЕРІВ
Початковим етапом розчинення полімеру є набрякання. Набрякання – це самочинний процес вбирання ВМС великих кількостей низькомолекулярної рідини, що супроводжується значним збільшенням об’єму та маси полімеру. Розрізняють 2 стадії набрякання. На першій стадії молекули розчинника сольватують певні групи полімеру, при цьому сольватний шар є мономолекулярним і компактним, що призводить до внутрішнього стиснення, ущільнення системи й зменшенні в об’ємі (контракції). Друга стадія набрякання не супроводжується виділенням теплоти, характеризується значним збільшенням маси, об’єму й призводить до розпушування сіток полімеру внаслідок осмотичного всмоктування великої кількості розчинника.
Якщо для полімеру характерне обмежене набрякання (між ланцюгами сильні міжмолекулярні зв’язки), то процес розчинення закінчується однією із стадій набрякання і веде до утворення еластичних драглів. Обмежене набрякання характерне для желатини у воді кімнатної температури. Необмежене набрякання властиве альбумінам, гумі, желатини у гарячій воді. За зміни зовнішніх умов обмежене набрякання може перейти в необмежене і навпаки.
Кількісними характеристиками процесу набрякання є ступінь і швидкість набрякання.
Характеристика |
Визначення |
Формула |
Примітка |
|||
Ступінь |
Це |
маса |
m -m0 |
mр |
Визначають |
|
набрякання (α) |
(об’єм) рідини, |
α = --------=------- |
для |
поліме- |
||
|
що |
вбирається |
, |
|
рів, |
які |
|
оди-ницею |
m0 |
m0 |
набрякають |
||
|
маси чи об’єму |
m0 (m) – маса по- |
обмежено |
|||
|
полімеру |
лімеру до (після) |
|
|
|
набрякання |
|
Швидкість |
Швидкість |
dm |
Рівняння |
набрякання |
дифу-зії |
υ=-----= κ(αmax- |
кіне-тики |
|
розчинника у |
ατ) |
набря-кання |
|
полімер |
dτ |
нагадує |
|
|
κ – константа |
рівняння |
|
|
наб-рякання, ατ – |
кіне-тики |
|
|
ступінь |
адсорбції |
|
|
набрякання за |
Ленгмюра |
|
|
час τ |
|
Здатність полімерів до набрякання зумовлюють такі чинники:
1.Природа полімеру та розчинника. Якщо ланки полімеру і молекули розчинника близькі за полярністю, то відбувається набрякання.
2.Молекулярна маса полімеру. Зі збільшенням молекулярної маси у полімер гомологічному ряді здатність до розчинення в одному
йтому ж розчиннику зменшується.
3.Температура. Можна оцінити за принципом Ле Шательє.
4.рН середовища. Вплив середовища на набрякання добре вивчений для білків. Амінокислоти у водних розчинах знаходяться у формі біполярних йонів (цвіттер-йонів):
H2N-R-COOH H3N+-R-COO-.
У кислому середовищі, внаслідок надлишку йонів Гідрогену зменшується йонізація карбоксильних груп,молекула білку веде себе як основа і набуває позитивного заряду. У лужному середовищі зменшується йонізація аміногруп, молекула білку веде себе як кислота і набуває негативного заряду.
|
|
|
|
+ |
- |
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
H3N-R-COO |
|
|
|
|
||
+ |
OH- |
|
|
|
|
|
OH- |
H N-R-COO |
- |
|
H N-R-COOH |
|
|
|
|
|
|
|
|
||
3 |
H+ |
|
|
|
|
|
H+ |
2 |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
H2N-R-COOH |
|
|
|
|
||
кисле |
|
|
|
|
|
|
|
|
лужне |
|
|
|
|
|
|
|
|
|
|
||
середовище |
|
|
|
ІЕТ |
|
|
|
|
середовище |
|
Якщо при йонізації на поверхні білку виникає однакова кількість позитивних і негативних зарядів, тобто сума електричних

зарядів дорівнює нулю ( =0) , то такий стан білку називають ізоелектричним, а значення рН розчину, при якому білок знаходиться в ізоелектричному стані називають ізоелектричною точкою (рНІЕТ). При цьому значенні рН протилежно заряджені групи притягуються одна до одної, молекула скорочується у спіраль і згортається у клубок. В ІЕТ набрякання мінімальне. Зміна рН в кислу чи лужну ділянку призводить до зростання ступеня набрякання (укус комах).
ІЕТ є важливою характеристикою білків, її можна визначити різними методами.
За електрофоретичною рухливістю. Досліджуваний білок піддають електрофорезу в буферних розчинах з різним значенням рН. В ІЕТ при рН = ІЕТ білок електронейтральний і в електричному полі не переміщається.
За швидкістю желатинування. У буферні розчини з різним значенням рН вносять концентрований розчин досліджуваного білка. Желатинування пройде найшвидше в розчині рН = ІЕТ.
За величиною набухання. Кількості сухого білку помішують у ряд пробірок, до них доливають рівні об’єми буферних розчинів з різними значеннями рН. Найменше набухання там, де рН = ІЕТ.
За мінімумом в’язкості також знаходять ІЕТ. В’язкість розчину білка найменша при рН = ІЕТ.
5.Електроліти. На набрякання впливають аніони нейтральних солей і дуже незначно катіони. За впливом на процес набрякання білків аніони розміщені в ліотропний ряд Гофмейстера:
SO42-→CIO4-→CH3COO-→CI-→NO3-→Br-→I-→SCN-
Зменшують набрякання Посилення набрякання
6. Ступінь подрібнення. Чим більший ступінь подрібнення, тим більша площа контакту полімеру з розчинником.
В’язкість розчинів полімерів. Специфічною властивістю розчинів ВМС є аномальна в’язкість. Причина високої в’язкості розчинів ВМС є досить сильна взаємодія гнучких макромолекул полімерів із молекулами розчинника, утворення асоціатів і внутрішніх структур.
На в’язкість впливає:
а) тиск - зменшується зі збільшенням тиску на текучу рідину; б) форма молекул - якщо лінійні частинки розміщені впоперек
потоку, то вони протидіють витіканню рідини. При збільшенні зовнішнього тиску ці частинки орієнтуються вздовж потоку і в’язкість зменшується;
в) концентрація - з ростом концентрації в’язкість розчинів ВМС різко зростає. Розчинені частинки утворюють структури, частина молекул розчинника потрапляє в петлі структур, тому об’єм вільного розчинника зменшується. При збільшенні зовнішнього тиску структури руйнуються, розчинник звільнюється, в’язкість зменшується. Коли вся структура зруйнується, розчини ВМС підчиняються постулату Ньютона і закону Пуазейля. Тому аномальну в’язкість таких розчинів називають ще структурною в’язкістю.
В’язкість пов’язана з молекулярною масою ВМС р і в нян ня м
Ей нш тей на - Ш та уд і нг е р а : пит. = К·С·М, де К - коефіцієнт, який є сталим для даного полімергомологічного ряду; С - концентрація; М -
молекулярна маса; пит. - питома в’язкість - це є відносне підвищення в’язкості дисперсійного середовища при додаванні до нього певної
кількості диспергованої фази:
пит. 0
00- в’язкість розчинника; - в’язкість розчину ВМС. Рівняння Штаудінгера можна записати так:
пит. К М
С
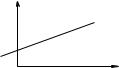
Величина пит/С:- п р и ве д ена в ’ яз кіс т ь . Для визначення молекулярної маси віскозиметричним методом вимірюють 0 і при
різних концентраціях, розраховують пит/С і будують графік
залежності пит/С від С.
Екстраполяція експериментальних даних на нульову концентрацію дасть величину ха р а к те р и сти ч но ї в язко ст і [ ], на основі якої розраховують М= [ ]К.
пит.
С
}[ ]
С
г) рН. Найменшу в’язкість розчини білків мають в області ізоелектричної точки, тому що в цій точці макромолекули білків утворюють найщільніші клубки. Ці клубки чинять найменший опір потоку рідини. Зі збільшенням чи зменшенням рН в’язкість розчинів білків зростає.
Осмотичний тиск біополімерів. Осмотичний тиск розчинів ВМС не підчиняється закону Вант-Гоффа: він зростає
