
- •Чернівці - 2012
- •Тема 4: Колігативні властивоcті розчинів
- •Тривалість заняття: 2 години
- •Вміти: проводити розрахунки на основі законів Рауля та Вант-Гоффа для розчинів електролітів та неелектролітів
- •Поради студенту
- •Теоретичні відомості з теми
- •Визначення осмотичної резистентності еритроцитів (стійкості до гемолізу)
- •Матеріали для самоконтролю
- •NNaOH VNaOH
- •Перший закон термодинаміки
- •Ентальпія
- •Теплові ефекти хімічних реакцій
- •Закон Гесса
- •ІІ закон термодинаміки. Ентропія
- •Ізобарно-ізотермічний потенціал (енергія Гіббса)
- •Порядок i молекулярнiсть реакції
- •Особливості біологічних каталізаторів
- •Інструкція для лабораторно-практичної роботи
- •Вплив температури на швидкість реакції розкладу натрію тіосульфату
- •Матеріали для самоконтролю. Завдання
- •Хімічна рівновага
- •Інструкція для лабораторно-практичної роботи
- •Визначення потенціалів окремих електродів
- •Матеріали для самоконтролю. Тести
- •Інструкція для лабораторно-практичної роботи
- •Йонно-обмінна адсорбція сульфосаліцилату натрію на Н-катіоніті
- •Матеріали для самоконтролю.Завдання.
- •Інструкція для лабораторно-практичної роботи
- •Визначення ІЕТ желатину за мінімумом в’язкості.
- •Матеріали для самоконтролю. Тести
клітинами. Молекули фосфоліпідів, на відміну від великих молекул білків, порівняно вільно переміщуються вздовж поверхні мембрани, залишаючись у межах свого шару. Мембрана має будову рідкого кристалу. При переході мембрани з рідкокристалічного стану в упорядкований її робота гальмується. У таких випадках спостерігається розвиток патологічних процесів в організмі – атеросклероз, утворення жовчних каменів.
ЗНАЧЕННЯ ПОВЕРХНЕВИХ ЯВИЩ У МЕДИЦИНІ
З усіх адсорбційних явищ найбільше використовується у сфері людської діяльності адсорбція на поверхні твердого тіла. Так, у медицині широко застосовуються гемосорбція, ентеросорбція, аплікаційна терапія та інші.
При гемосорбції кров очищується від токсинів середньої молекулярної маси пропусканням її через адсорбенти – активоване вугілля різних марок. Тепер для цього використовують шматки селезінки тварин. Апарати для гемосорбції інколи називають "штучною печінкою". Вони застосовуються при нирковій чи печінковій недостатності для лікування ботулізму, отруєнь грибами, ліками, білої гарячки, а також атеросклерозу і псоріазу.
Різновидом ентеросорбції є використання активованого вугілля (карболену) та інших адсорбентів всередину для зв’язування отрут та токсинів середньої молекулярної маси в шлунково-кишковому тракті.
Аплікаційна терапія, що застосовується для лікування опіків та інших поверхневих патологій, також заснована на адсорбційних явищах.
Адсорбція використовується при фракціонуванні і розділенні різних речовин, в гетерогенному каталізі, в технології очистки харчових продуктів (цукру, спирту, гліцерину), в пом’якшенні води за допомогою пермутитів, глауконітів, йонітів, а також, з метою захисту і очистки навколишнього середовища.
Інструкція для лабораторно-практичної роботи
Йонно-обмінна адсорбція сульфосаліцилату натрію на Н-катіоніті
1.Регенерація катіоніту. Розчин із колонки випускають так, щоб над адсорбентом залишався ще шар рідини біля 0,5 см. Далі через колонку пропускають двічі по 5 мл 2 н. соляної кислоти і відмивають її від надлишкової кислоти, додаючи 10 раз по 5 мл дистильованої води до нейтральної реакції за метилоранжем (жовте забарвлення).
2. Йонообмінна адсорбція сульфосаліцилату натрію і визначення його концентрації у розчині. Через регенеровану колонку пропускають точно 5,00 мл досліджуваного розчину сульфосаліцилату натрію і 5 раз по 5 мл дистильованої води. В результаті іонного обміну на виході з колонки ми дістаєм розчин сульфосаліцилової кислоти, який, разом а промивними водами, збирають у колбу для титрування. Сюди додають 1-2 краплі фенолфталеїну і титрують 0,100М розчином їдкого натру до появи рожевого забарвлення.
Концентрацію досліджуваної речовини розраховують за формулою: N(NаОН)·V(NаОН)
N(х) =
Vдосл. розчину
Vдосл. розчину = 5 мл,
V(NаОН) - об’єм робочого розчину, що пішов на титрування.
Матеріали для самоконтролю. Контрольні питання:
1.Як поділяють речовини за їх впливом на поверхневий натяг та чому молекули ПАР у водних розчинах адсорбуються на межі поділу фаз?
2.Який математичний запис рівняннь адсорбції Ленгмюра та Фрейдліха-Шилова і яку залежність вони описують?
3.В чому полягає правило вирівнювання полярностей Ребіндера?
4.Наведіть класифікацію хроматографічних методів
5.Поверхневий натяг сироватки крові при 37°С рівний 46.0.10-3 н/м, а води – 70,7.10-3 н/м. Доведіть, яке значення (Г > О чи Г < О) має адсорбція крові при її розчиненні у воді.
6.Активоване вугілля використовують при різних шлунковокишкових захворюваннях. Чому для цієї мети не можна використати силікагель, глину?
7.Який із адсорбентів: вугілля чи силікагель, найкраще вибрати для осушки ефіру і хлороформу, що використовуються в медичній практиці?
8.Що таке катіоніти і аніоніти та як за допомогою йонообмінної адсорбції одержати знесолену воду?
9.Питома поверхня активованого вугілля складає 500 м2/г. Скільки міліграм фосгену (М = 101 г/моль) поглинеться поверхнею 100 м2, якщо 1 грам вугілля адсорбує 360 мл газу (н.у.)?
Зразок білету для кінцевого контролю знань студентів
1. Який адсорбент краще використати для очистки лікарських засобів від вологи?
А.Силікагель В.Тальк С.Вугілля D.Целюлоза Е. Глина
2. Вкажіть неправильне твердження стосовно хроматографії.
А. Аналіз, що базується на процесі десорбції.
В. Дослідження речовин, близьких за адсорбційними властивостями. С. Розділення, очистки та аналізу речовин на основі їх різних адсорбційних властивостей.
D. Видалення адсорбованих речовин з поверхні адсорбента.
Е. Аналіз, що ґрунтується на визначенні об’єму розчину відомої концентрації.
3. На які частинки обмінюють свої рухливі аніони аніоніти?
А.Катіони з розчину.
В.Аніони з розчину в еквівалентних кількостях. С.Катіони і аніони.
D.Поглинають аніони з розчину. Е. Молекули води.
|
4. Знайдіть відповідність. |
|
1 |
Сорбція |
A. Видалення адсорбованих молекул з поверхні |
|
|
адсорбенту |
2 |
Адсорбція |
B. Перехід речовини із зони меншої концентрації в |
|
|
зону більшої концентрації, що відбувається на |
|
|
межі поділу фаз |
3Абсорбція C. Концентрація однієї речовини в об’ємі іншої
4Десорбція D. Поглинання газів і випарів твердими тілами
5Елюція E. Процес, зворотний до адсорбції, що протікає за
допомогою розчинників
5.Вкажіть невірне твердження стосовно адсорбції газів на твердих поверхнях.
A.Адсорбція зумовлена фізико-хімічною взаємодією адсорбенту і адсорбтиву.
B.Адсорбція проходить не на всій поверхні, а на активних центрах.
C.Адсорбція протікає тільки до утворення мономолекулярного шару адсорбтиву.
D.Адсорбційний процес є рівноважним.
E.З підвищенням температури адсорбція збільшується.
6.Вирахувати величину адсорбції ізоамілового спирту (в моль/м2)
при 292 К у його розчині з концентрацією 0,2 моль/л, якщо гранична адсорбція 8,70 10-6 моль/м2, а константа у рівнянні Ленгмюра = 42моль/м3.
РЕКОМЕНДОВАНА ЛІТЕРАТУРА
Основна: Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. – Вінниці: Нова книга. – 2006. – С. 562-601.
Додаткова: Мороз А.С. Біофізична та колоїдна хімія /А.С.Мороз, Л.П.Яворська, Д.Д.Луцевич. –Вінниця: Нова книга, 2007.-С.350-393.
ТЕМА 12. ОДЕРЖАННЯ, ОЧИСТКА, ВЛАСТИВОСТІ КОЛОЇДНИХ
РОЗЧИНІВ ТА ЇХ КОАГУЛЯЦІЯ
АКТУАЛЬНІСТЬ ТЕМИ. Дисперсні системи широко розповсюджені як у неживій, так і у живій природі. Кров, протоплазма, біологічні мембрани, волокна, віруси – це колоїдні утворення. Окрема клітина живого організму є гетерогенною колоїдною системою, утвореною високомолекулярними і низькомолекулярними сполуками. Тканина – це гетерогенна система вищого порядку, де дисперсною фазою є клітина, а дисперсійним середовищем – рідина, що її оточує. Тому знання властивостей і особливостей колоїдно-дисперсних систем є необхідною умовою розуміння дуже складних процесів життєдіяльності організмів.
ТРИВАЛІСТЬ ЗАНЯТТЯ: 2 год
НАВЧАЛЬНІ ЦІЛІ ЗАНЯТТЯ. Студент повинен:
знати основні поняття теми;
класифікувати дисперсні системи за різни ми ознаками;
аналізувати відмінні особливості окремих типів дисперсних систем;
знати методи одержання та очищення дисперсних систем;
інтерпретувати основні молекулярно-кінетичні оптичні та електричні властивості дисперсних систем, пояснювати причини, які їх зумовлюють;
розрізняти складові частини подвійного електричного шару колоїдних часточок та пояснювати, яка на них впливає додавання електролітів;
розрізняти складові частини міцели та складати формули міцел золів;
аналізувати фактори стійкості дисперсних систем, закономірності та механізм їх коагуляції;
розрізняти особливі випадки коагуляції та пояснювати їх причини.
ПОРАДИ СТУДЕНТУ
Підготуйте питання до практичного заняття і виконайте вказівки до них.
Питання |
|
|
Вказівка |
|
|
|
Загальна |
|
Зверніть увагу на поняття «дисперсна |
|
|||
характеристика |
фаза», |
«дисперсійне |
середовище», |
|
||
дисперсних систем |
«диспергування». |
|
|
|||
|
|
Зауважте |
на |
класифікаціях |
дисперсних |
|
|
|
систем. |
|
|
|
|
Питання |
|
|
Вказівка |
|
|
|
Методи |
одержання |
З’ясуйте |
суть |
кожного методу очистки |
|
|
та |
очищення |
(діаліз, електродіаліз, ультрафільтрація, |
|
|||
колоїдних розчинів |
гемодіаліз) і вкажіть межі застосування |
|
||||
Будова |
колоїдних |
Зверніть увагу на механізм утворення |
|
|||
часточок |
|
подвійного електричного шару |
|
|||
Властивості |
Поясніть причини, що зумовлюють |
|
||||
колоїдних систем |
молекулярно-кінетичні, електрокінетичні |
|
||||
|
|
та оптичні властивості |
|
|
||
Застосування |
Див. методичні рекомендації для СРС |
|
||||
електрофорезу |
«Застосування електрофорезу в клініко- |
|
||||
|
|
лабораторній практиці» |
|
|
||
Стійкість |
|
Проаналізуйте |
фактори |
стійкості |
|
|
дисперсних систем |
дисперсних систем |
|
|
|||
Коагуляція. Поріг |
З’ясуйте механізм коагулювальної дії |
|
||||
коагуляції |
електролітів |
|
|
|
||
Процеси коагуляції |
Див. методичні рекомендації для СРС |
|
||||
при очистці води |
«Процеси коагуляції при очистці питної |
|
||||
|
|
води та стічних вод» |
|
|
||
Теоретичні відомості з теми
ЗАГАЛЬНА ХАРАКТЕРИСТИКА ДИСПЕРСНИХ СИСТЕМ
Ди сп ер с ни ми називаються системи, в яких більш чи менш подрібнена речовина (речовини) дисперсної фази рівномірно розподілена в об'ємі дисперсійного середовища. Необхідною умовою утворення дисперсної системи є обмежена розчинність речовини дисперсної фази у дисперсійному середовищі.
Ди сп ер гу ва н ня – це подрібнення речовини.
Го мо ге н но ю називають систему, в якій диспергована речовина не має поверхні поділу із дисперсійним середовищем.
Ге тер о ге нно ю називають систему, в якій частинки диспергованої речовини мають розмір більший за 10-9 м і складають окрему фазу щодо дисперсійного середовища. Гетерогенні системи
характеризуються такими ознаками: наявність поверхні поділу (гетерогенність), дисперсність (D = 1/d), питома поверхня частинок фази (Sпит=Sсум/V).
Класифікація дисперсних систем
Дисперсні системи класифікують за розміром частинок, міжфазною взаємодією, агрегатним станом дисперсної фази і дисперсійного середовища, за природою дисперсійного середовища.
Класифікація дисперсних систем за розміром частинок
|
Вид дис- |
Струк- |
|
Діа- |
|
Властивості |
Приклади |
|||
|
персної |
турна |
|
|
||||||
|
|
метр |
|
системи |
|
систем |
||||
|
системи |
одиниця |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
||
|
Істинні |
Молекула, |
10-9- |
|
Гомогенні, прозорі, |
Розчини |
||||
|
|
йон |
|
10-10 м |
|
термодинамічно |
|
сильних |
||
|
|
|
|
|
|
стійкі, оптично пусті, |
електро- |
|||
|
|
|
|
|
|
швидко дифундують, |
літів |
|||
|
|
|
|
|
|
проходять крізь папе- |
|
|
||
|
|
|
|
|
|
ровий фільтр, напів- |
|
|
||
|
|
|
|
|
|
проникні мембрани |
|
|
||
|
Колоїдні |
Міцела |
|
10-7- |
|
Ультрамікрогетероге |
Розчини |
|||
|
(високо- |
|
|
10-9 м |
|
нні, прозорі, розсію- |
гідрооксидів |
|||
|
дисперсні) |
|
|
|
|
ють світло, агрега- |
феруму, |
|||
|
|
|
|
|
|
тивно малостійкі, по- |
алюмінію |
|||
|
|
|
|
|
|
вільно дифундують, |
|
|
||
|
|
|
|
|
|
не проходять крізь |
|
|
||
|
|
|
|
|
|
ультрафільтр, |
|
|
|
|
|
|
|
|
|
|
мембрани |
|
|
|
|
|
Грубо- |
Кристал |
|
>10-7м |
|
Мікрогетерогенні, |
Суспензії, |
|||
|
дисперсні |
|
|
|
|
непрозорі, заломлю- |
емульсії, |
|||
|
|
|
|
|
|
ють світло, кінетично |
дими, |
|||
|
|
|
|
|
|
нестійкі, не дикун- |
пористі тіла |
|||
|
|
|
|
|
|
дують, не проходять |
|
|
||
|
|
|
|
|
|
крізь фільтр |
|
|
|
|
|
Класифікація дисперсних систем за міжфазною |
|||||||||
|
|
|
|
взаємодією |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
Вид |
Характеристики |
|
|
|
|
||||
|
дисперсної |
|
Приклади |
|||||||
|
|
системи |
|
|
||||||
|
системи |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ліофільні |
Спорідненість між фазою та |
Розчини ВМС, білків, |
||
(гідрофільні) |
середовищем, |
термодина- |
полісахаридів, |
|
|
мічно стійкі |
|
каучука |
|
Ліофобні |
Мікрогетерогенні |
системи, |
Колоїдні |
розчини, |
(гідрофобні) |
термодинамічно нестійкі |
гідрофобні воді |
||
Класифікація дисперсних систем за агрегатним станом дисперсної фази і дисперсного середовища
|
|
|
Агрегатний |
|
|
|
|
|
|
|
Вид дисперсної |
|
стан дис- |
|
Приклади |
|
|
|
|
|
системи |
персної фази |
|
|
|
|
|||
|
|
|
|
|
|
||||
|
|
/середовища |
|
|
|
|
|
||
|
|
|
|
Г/Г |
|
Атмосфера Землі |
|
|
|
|
Аерозоль рідкий |
|
|
Р/Г |
|
Туман, хмари |
|
|
|
|
Аерозоль твердий |
|
|
Т/Г |
|
Дим, пил, порошки |
|||
|
Піни, газові емульсії |
|
|
Г/Р |
|
Мильна піна |
|
|
|
|
Емульсії |
|
|
Р/Р |
|
Молоко, майонез, креми |
|
||
|
Суспензії |
|
|
Т/Р |
|
Розчин вапна, крейди |
|||
|
Тверді піни |
|
|
Г/Т |
|
Пінопласти, |
|
|
|
|
|
|
|
|
|
активоване вугілля |
|
||
|
Тверді емульсії |
|
|
Р/Т |
|
Вода у парафіні, опал |
|
||
|
Тверді солі |
|
|
Т/Т |
|
Кольорове |
скло, |
||
|
|
|
|
|
|
дорогоцінне каміння |
|
||
|
Класифікація дисперсних систем за природою |
||||||||
|
дисперсійного середовища |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
Вид дисперсної |
|
Дисперсійне середовище |
||||||
|
системи |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
Гідрозолі |
|
|
середовище-вода |
|
|
|
||
|
Органозолі |
|
|
середовище-органічний розчинник |
|||||
|
Алкозолі |
|
|
розчинник-спирт |
|
|
|
||
|
Етерозолі |
|
|
розчинник-ефір |
|
|
|
||
|
Бензозолі |
|
|
розчинник-бензен |
|
|
|
||
|
МЕТОДИ ОДЕРЖАННЯ ЗОЛЕЙ |
|
|
|
|||||
|
Ко ло їд ни й р о зчи н (золь) – це |
ультрамікрогетерогенна |
|||||||
система, у якій дисперсійним середовищем є рідина, а дисперсною фазою – тверді частинки розміром 10-7 – 10-9 м.
Методи одержання гідрофобних золів. Умовами утворення колоїдних розчинів є: а) мала розчинність речовини дисперсної фази у

дисперсійному середовищі; б) відповідний ступінь дисперсності речовини (1-100 нм), в) наявність стабілізатора (найчастіше йонів електроліту), який надає частинкам дисперсної фази однойменного заряду, що перешкоджає їх об’єднанню (агрегації). Розрізняють конденсаційні та диспергаційні методи одержання золей (див. табл.20).
Таблиця 20. Методи одержання золей
Назва методу |
Суть методу |
І. Фізичні конденсаційні методи (для одержання золей із істинних перенасичених розчинів шляхом агрегації частинок із застосуванням фізичних явищ)
1.Конденсація |
Зі зниженням температури тиск пари стає більшим |
пари |
за рівноважний тиск над рідиною (твердим тілом), в |
|
результаті чого у газовій фазі утворюються крапли- |
|
ни рідини (туман) чи тверді частинки (дим). |
2. Метод |
Ґрунтується на заміні середовища, що відбувається |
заміни розчин- |
при додаванні невеликої кількості істинного |
ника |
розчину речовини до розчинника, в якому ця |
|
речовина нерозчинна, але обидва розчинника |
|
необмежено змішуються. Це призводить до |
|
виділення її у вигляді високодисперсної системи. |
3.Електродуго- |
Грунтується на утворенні парів металу у вольтовій |
вий метод |
дузі з наступною їх конденсацією в охолодженому |
Бредіга |
розчиннику. |
ІІ. Хімічні конденсаційні методи (для одержання золей із істинних перенасичених розчинів шляхом агрегації частинок із застосуванням хімічних реакцій)
Хімічна |
В основі лежать хімічні реакції (обміну, гідролізу, |
конденсація |
ОВР), що супроводжуються утворенням мало- |
|
розчинних речовин за наявності надлишку |
|
стабілізатора. |
ІІІ. Фізичні диспергаційні методи (для одержання золей шляхом подрібненням великих частинок фізичним методами)
Механічне |
Подрібнення, розтирання речовини з допомогою |
диспергування |
млинів. |
Електричні |
Крізь рідке дисперсійне середовище пропускають |
методи дис- |
електричний струм між електродами, які виготовле- |
пергування |
ні з металу, золь якого хочуть одержати. |
Акустичні |
Грунтуються на використанні спрямованого |
методи |
ультрафіолетового поля (коливань великої частоти. |
ІV. Хімічні диспергаційні методи (для одержання золей шляхом подрібненням великих частинок хімічними реакціями)
Метод |
Колоїдний розчин дістають із грубодисперсної |
пептизації |
системи (свіжоутвореного осаду) з допомогою |
|
стабілізатора-пептизатора. Розрізняють 3 способи |
|
пептизації: адсорбційний, дисолюційний, проми- |
|
вання осаду розчинником. |
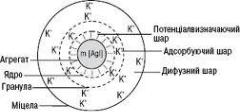
ПОНЯТТЯ ПРО МІЦЕЛЯРНУ БУДОВУ ЧАСТИНОК
Для пояснення будови дисперсних частинок була використана тео р ія по дв і й но го е л е к тр ич но го ш ар у (ПЕШ), створена на основі досліджень електродного потенціалу, що виникає на межі метал-розчин. Ці уявлення про будову подвійного електричного шару лежать в основі міцелярної теорії будови колоїдних частинок, згідно з якою золь складається із структурних частинок дисперсної фази – міцел і міжміцелярної рідини, що містить і електроліти, неелектроліти, ПАР, які стабілізують систему.
Міцела має складнішу будову, ніж, структурна одиниця істинних розчинів - молекула, бо є агрегатом із багатьох молекул, атомів чи йонів. Вона електронейтральна. У ній можна розрізнити три складові частини: ядро, адсорбційний шар йонів та дифузійний шар йонів. Ядро складає основну масу міцели і являє собою мікрокристали малорозчинної сполуки, що нараховує від сотень до кількох мільйонів молекул, атомів чи йонів. На поверхні ядра адсорбуються ті йони стабілізатора (потенціалвизначальні йони), які можуть добудувати кристалічну гратку. Під дією електростатичних сил до поверхні ядра притягуються йони стабілізатора протилежного знаку - частину протийонів, утворюючи адсорбційний шар. Ядро разом з адсорбційним шаром складають гранулу, заряд якої і є дзета-потенціалом. Заряд, який надають твердій фазі потенціалвизначальні йони називається повним, або термодинамічним потенціалом. Гранула завжди несе знак заряду потенціалвизначальних йонів.
Решта протийонів, яка необхідна для повної компенсації заряду поверхні, слабше зв’язані з ядром, поступово дифундують у напрямку розчину й утворюють дифузний шар.
Чинники, що впливають на товщину дифузійного шару, змінюють значення дзета-потенціалу. Протийони дифузійного шару не зазнають
такого великого притягання, як йони адсорбційного шару, тому зберігають свободу пересування. Вони можуть сольватуватись (гідратуватись), що поряд із дзета-потенціалом визначає стійкість золів. Гранула разом з дифузійним шаром утворюють міцелу.
Є ще й інший потенціал дисперсної частинки, який проявляється лишень при русі фази відносно середовища. Він представляє собою падіння потенціалу тільки в дифузійному шарі і називається
електрокінетичним або дзета-потенціалом. Його величина є найважливішою характеристикою стійкості ліофобних золів і проявів фізіологічної дії. У загальному випадку дзета-потенціал ( -потенціал) менший за термодинамічний потенціал.
Будову міцели прийнято зображати міцелярними формулами. Розглянемо будову міцели золю арґентум йодиду, одержаного методом хімічної конденсації. Для цього можна використати обмінну реакцію:
АgNО3 + КІ АgІ + КNО3
Якщо у надлишку взяти арґентум нітрат, то він зіграє роль стабілізатора. Згідно пр ав и ла Па не т та -Ф ая нс а на твердій поверхні в першу чергу адсорбуватимуться йони, які входять в її склад або ізоморфні їй. Із двох видів, які постачає арґентум нітрат, на поверхні АgІ адсорбуватимуться в першу чергу йони арегнуму, вони будуть потенціалвизначальними, а нітрат-йони - протийонами. У цьому випадку гранула зарядиться додатньо.
Тоді міцела матиме будову:
[m(AgI). nAg+. (n-x)NO-3 ] . xNO3-
Ядро Адсорбційний |
Дифузійний |
шар |
шар |
Якщо у надлишку взяти йодид калію, то він буде стабілізатором, гранули нестимуть негативний заряд, а міцела матиме будову:
[m(AgI). nІ-. (n-x)К+] . xК+
Виникнення подвійного електричного шару в результаті дисоціації поверхневих йоногенних груп можна розглянути на прикладі скла, що знаходиться в контакті з водою. На такій поверхні є молекули метакремнієвої кислоти, що дисоціюють за схемою:
H2SiO3  H+ + HSiO3-
H+ + HSiO3-

Формула міцели {m[SiO2] nHSiO3– (n-x)H+}x–xH+.
МЕТОДИ ОЧИСТКИ КОЛОЇДНИХ СИСТЕМ
Для збільшення стійкості колоїдних систем їх очищають найперше від низькомолекулярних сполук та електролітів. Для цього використовують діаліз, електродіаліз, ультрафільтрацію, а для розділення компонентів дисперсної системи та їх тонкого фракціонування - ще й ультрацентрифугування (табл. 21).
Таблиця 21. Методи очистки колоїдних систем
Назва |
Суть методу |
|
Застосування |
||||
методу |
|
||||||
|
|
|
|
|
|
|
|
Діаліз |
Ґрунтується |
на |
застосуванні |
Гемодіаліз |
- очистка |
||
|
напівпроникних |
мембран, що |
крові |
від |
сечовини, |
||
|
пропускають йони і молекули, |
сечової |
|
кислоти, |
|||
|
але затримують колоїдні частин- |
надлишків К+, СІ- |
|||||
|
ки. Низькомолекулярні домішки |
Апарат |
|
"штучна |
|||
|
проходять крізь мембрану у роз- |
нирка". |
|
|
|||
|
чинник і виносяться проточною |
Компенсаційний діа- |
|||||
|
водою доти, поки не вирів- |
ліз - для встановлення |
|||||
|
няється концентрація |
домішок |
концентрації НМС у |
||||
|
по обидва боки мембрани. |
колоїдному розчині. |
|||||
Електро- |
Процес очищення золів від до- |
Для |
|
очищення |
|||
діаліз |
мішок електролітів у електрич- |
розчинів |
білків, |
||||
|
ному полі. Електро-діалізатор |
сироваток, |
|
||||
|
складається з трьох камер. У |
промислових стоків. |
|||||
|
середню камеру, що відділена від |
|
|
|
|||
|
бокових напівпроникними |
|
|
|
|||
|
мембранами, наливають очищу- |
|
|
|
|||
|
ваний золь, а в бокових камерах |
|
|
|
|||
|
розміщені електроди, на які |
|
|
|
|||
|
подається постійна напруга. |
|
|
|
|||
Ультра- |
Метод очистки шляхом фільт- |
В якості мембранних |
|||||
фільтрація |
рування золів під тиском через |
фільтратів в біохіміч- |
|||||
|
ультрафільтри, |
які пропускають |
ній практиці і мікро- |
||||
|
дисперсійне середовище разом з |
біології |
використову- |
||||
|
низькомолекулярним |
доміш- |
ють ацетат целюлози, |
||||
|
ками, але затримують міцели. |
нітроцелюлозу, |
|||||
|
|
|
|
скловолокно. |
Ультра- |
Ґрунтується |
на |
розділенні |
Застосовують для роз- |
центри- |
частинок різної маси в цен- |
ділення біополімерів, |
||
фугування |
тробіжному |
полі |
великих |
вірусів, субклітинних |
|
прискорень. |
|
|
елементів |
|
ВЛАСТИВОСТІ КОЛОЇДНИХ СИСТЕМ |
|||
Із м о л е к у л я р н о - к ін ети ч ни х в ла с ти во стей для колоїдних розчинів, як і для істинних, характерні дифузія та осмотичний тиск. Але ці колігативні властивості (залежать тільки від сумарного числа частинок у розчині) для колоїдів мають значно меншу величину, що зумовлено більшим розміром частинок. З цієї ж причини колоїдним системам властиві і особливі, специфічні, молекулярно-кінетичні явища - броунівський рух і седиментація.
|
Хаотичний рух частинок в мікрогетерогенних |
Броунівський |
системах. |
рух |
Броунівський рух є наслідком теплового руху |
|
частинок дисперсійного середовища. Колоїдні |
частинки відчувають на собі безліч ударів молекул розчинника і якщо частинка розміром мала (< 5 нм), то число ударів з різних сторін буде не однаковим і вона дістане імпульси, що змістять її в різних напрямках. Визначити траєкторію руху частинок через велике число відхилень (до 10 разів за сек.) неможливо, однак можна визначити середнє зміщення частинки, яке залежить від коефіцієнту дифузії і
часу спостереження. |
|
|
|
Дифузія |
Процес самовільного |
вирівнювання концентрації |
|
диспергованої речовини під впливом теплового |
|||
|
|||
|
хаотичного руху як частинок дисперсної фази так |
||
і дисперсійного середовища. Швидкість |
дифузії для колоїдних і |
||
істинних розчинів характеризується за ко но м Ф і ка : m DS C , де, mX
-маса дифундованої речовини; S - площа поперечного перетину, через яку проходить дифузія; С/Х - градієнт концентрації; - час дифузії; D
-коефіцієнт дифузії.
За формулою Стокса-Ейнштейна коефіцієнт дифузії тим більший, чим вища температура, менша в’язкість середовища (η) і радіус частинок (r): D=RT/N·6π·η· r.
Інтенсивність броунівського руху тим більша, чим менший розмір частинок і вища температура. Тому у золях частинки яких значно більші за молекули та йони, швидкість дифузії мала.
Осмотичний
тиск
Низька концентрація колоїдних розчинів спричиняє дуже малий осмотичний тиск, який через агрегацію частинок не є постійним.
За законом Вант-Гоффа: = СRТ = υκТ, κ –
стала Больцмана.
Осмотичний тиск двох розчинів обернено пропорційний кубу радіусів їх частинок: 1/ 2= r23/ r13
Седиментація |
Процес осідання колоїдних частинок під дією |
|
сил земного тяжіння. |
||
|
||
|
Швидкість осідання частинок залежить від |
радіусу частинок (r), різниці між густинами дисперсної фази (ρ) і
дисперсійного середовища (ρ0), в’язкості середовища (η) і для |
|
частинок сфер форми: |
V=2 r2(ρ- ρ0)·g/9η. |
У результаті |
взаємодії броунівського руху, дифузії, |
седиментації, що мають протилежний напрямок, встановлюється седиментаційно-дифузійна рівновага, за якої спостерігається певний розподіл частинок по висоті – гіпсометричний розподіл частинок. Описується за ко но м Ла п ла са - Пер р е на :
ln ν1/ν2 = m·g(h2-h1)(ρ-ρ0)NA/RTρ, де m – маса частинки, ν1, ν2 –концентрації по висоті h1, h2 від дна посудини.
Здатність дисперсних систем, у тому числі й золів зберігати відповідний розподіл частинок у всьому об’ємі дисперсійного середовища, називають седи ме н та ц ій но ю ш ви д кі стю (тим більша, чим менший розмір частинок).
Седиментаційний аналіз дозволяє фракціонувати речовини, визначати розміри частинок, ступінь дисперсності, молекулярну масу та інші параметри деяких дисперсних систем Оптичні властивості. При проходженні світла крізь диспер-
сні системи спостерігаються явища проходження, вбирання, заломлення, відбиття, розсіювання світла. Залежно від співвідношення між довжиною хвилі падаючого світла та розмірами частинок системи може переважати той чи інший процес. Так для істинних розчинів переважає проходження світла, для грубодисперсних – відбиття. Колоїдно-дис- персні системи характеризуються оптичною неоднорідністю, а відповідно переважаючим є процес дифракційного розсіювання світла.
Для спостереження розсіювання необхідно через колоїдний розчин, що знаходиться в посудині з плоскопаралельними стінками, пропустити лиш промінь світла. Спостерігаючи цей розчин збоку в темній кімнаті, можна побачити світіння - каламутний конус. Це явище називається конусом Тіндаля (ефект Тіндаля). Причиною цього явища є опалесценція. Чисті рідини і справжні, (істинні) розчини конуса Тінда-

ля не утворюють. Конус Тіндаля - світіння пилинок повітря - можна спостерігати при попаданні променя світла в темну кімнату або на темному фоні неба (промінь прожектора).
Світлорозсіювання кількісно описується за ко но м Ре лея , згідно якому інтенсивність розсіяного світла (І) прямо пропорційна числу частинок (n), квадрату об'єму частинок (V2) і обернено пропорційна четвертій степені від довжини хвилі ( 4) падаючого світла:
, де, Іо - інтенсивність падаючого світла, К - константа, що залежить від показників заломлення дисперсної фази і дисперсійного середовища.
У відповідності із законом Релея, при проходженні променя білого світла через дисперсну систему більшою мірою розсіюються більш короткі хвилі, тобто синьої частини спектру. Тому вдень колір неба блакитний, йде розсіювання найбільш короткохвильової частини сонячного світла на флуктуаціях густини атмосфери.
Захід і схід сонця червоні, тому що їх ми спостерігаємо через нижні шари атмосфери, що містять великі частинки пилу і диму, особливо при вітряній погоді.
Явище розсіювання світла використовують в оптичних методах вивчення колоїдних систем, для визначення концентрації золів, розмірів колоїдних частинок та іншого. Для цього були сконструйовані спеціальні прилади: нефелометри, ультрамікроскопи, електронні мікроскопи.
Електрокінетичні властивості. До електрокінетичних властивостей колоїдних систем відносять електрофорез, електроосмос, потенціал протікання (перебігу) та потенціал осідання (седиментації).
Під впливом зовнішнього електричного поля, прикладеного до золю, його гранули починають рухатися до одного з електродів, а протийони дифузійного шару разом із своїми гідратними оболонками - до іншого.
Рух заряджених колоїдних частинок до Електрофорез протилежно зарядженого електроду
називається електрофорезом.
Швидкість електрофорезу V описується рівнянням ГельмгольцаСмолуховського:
V |
EHZ |
; |
|
V |
V |
EHZ |
; |
|
4π |
або H |
0 |
4π |
|
||
|
|
|
|||||
де V0 - електрофоретична рухливість колоїдної частинки, вимірюється в м2/В с; Н - напруженість електричного поля, В/м; Н = U/l, де U - напруга, В; l - відстань між електродами, м; Z - дзета-потенціал, В; - вязкість середовища, Н с/м; Е - діалектрична проникність середовища. Для більшості колоїдних частинок дзета-потенціалу знаходиться в межах 0-100 мВ.
Електрофорез застосовують як ефективну фізіотерапевтичну
процедуру. |
|
|
Електроосмос |
Переміщення дисперсійного середовища |
|
відносно нерухомої дисперсної фази до ін- |
||
|
||
|
шого електроду |
|
Методом електрофорезу та електроосмосу користуються для |
||
визначення величини електрокінетичного потенціалу дисперсних
частинок, для очистки та розділення білків, ферментів. |
|
|||
Потенціал |
Якщо протискувати золь через напівпроникну |
|||
мембрану, що пропускає тільки дисперсійне |
||||
перебігу |
||||
середовище і затримує гранули, то по обидві |
||||
|
||||
сторони мембрани виникне різниця |
потенціалів, що |
називається |
||
п о те нц іа ло м п р о т іка ння . Він |
є джерелом |
виникнення |
||
біопотенціалів. При протіканні крові по капілярах кровоносної системи виникає потенціал перебігу, який відображається зубцем на
кардіограмі людини. |
|
|
Різниця потенціалів, що виникає при осіданні |
Потенціал |
частинок дисперсної фази між електродами, |
седиментації |
що знаходяться на різній висоті у колоїдному |
|
розчині. |
|
Потенціал седиментації спостерігається при |
роботі центрифуг.
Усі чотири електрокінетичні явища: електроосмос, електрофорез, потенціал перебігу та потенціал седиментації дають змогу виміряти величину дзета-потенціалу колоїдних частинок.
СТІЙКІСТЬ ДИСПЕРСНИХ СИСТЕМ
Стійкість дисперсних систем – здатність системи впродовж певного часу зберігати незмінними склад та основні властивості: дисперсність, концентрацію, рівномірний розподіл частинок дисперсної фази у дисперсійному середовищі та характер взаємодії між частинками.
Стійкість дисперсних систем різна. Деякі системи можуть існувати довго. Інші зберігають стійкість протягом кількох секунд після їх утворення. Найбільш нестійкими в гідрофобні колоїдні системи, для
яких характерна слабка взаємодія між частинками дисперсної фази і дисперсійного середовища.
Розрізняють кінетичну та агрегативну стійкість (М.Пєсков, 1920).
Стійкість проти осідання під дією сил земного тяжіння.
Вона проявляється у збереженні рівномірного розподілу частинок у об'ємі розчину. Основна умова седиментаційної стійкості
золів є малий розмір їх частинок (високий ступінь дисперсності) та інтенсивний броунівський рух. Седиментаційна стійкість практично не залежить від концентрації золю, температури та зовнішніх умов. Тому колоїдні розчини на відміну від грубодисперсних систем, є кінетично стійкими.
Агрегативна Стійкість проти злипання або злиття стійкість колоїдних частинок у більш крупні агрегати
при їх зіткненні.
Вона проявляється в здатності систем утримувати певний ступінь дисперсності фази. Агрегативна стійкість зменшується з підвищенням концентрації золю, його температури та зміні інших зовнішніх факторів, в т.ч. при струшуванні і перемішуванні, а також самовільно у часі (старіння золів). Процес укрупнення колоїдних частинок за рахунок їх агрегації в результаті втрати агрегативної стійкості називається коагуляцією колоїдних розчинів.
Агрегативна та седиментаційна стійкість дисперсних систем безпосередньо пов'язані між собою. Доки колоїдний розчин зберігає агрегативну стійкість, він стійкий і седиментаційно. Втрата агрегативної стійкості призводить до втрати седиментаційної стійкості. Під дією сили тяжіння відбувається розділення фаз дисперсної системи і агреговані частинки випадають в осад.
Чинники стійкості дисперсних систем. Більшість ліофобних золів є агрегативно стійкими протягом тривалого часу, що зумовлено дією кількох чинників – електростатичного та адсорбціцносольватного.
Електростатичний бар’єр створює сили відштовхування між однойменно зарядженими колоїдними частинками (визначається величиною -потенціалу).
Адсорбційно-сольватний чинник стійкості виявляється в тому, що протийони дифузного шару сольватуються і створюють захисну
йонно-сольватну оболонку, яка є механічним бар’єром, що перешкоджає коагуляції.
Крім того, є ще один фактор стійкості, що зв'язаний із адсорбційними властивостями дисперсних систем. Як відомо, на добре розвинутій поверхні дисперсної фази легко адсорбуються молекули поверхнево-активних речовин (ПАР) та високомолекулярних сполук
(ВМС).
КОАГУЛЯЦІЯ. ПОРІГ КОАГУЛЯЦІЇ
Коагуляція – це процес зменшення дисперсності системи за рахунок укрупнення частинок дисперсної фази. До коагуляції золів можуть привести різноманітні зовнішні дії - зміна температури, струшування, перемішування, опромінення, додавання хімічних речовин і т.д.
Найважливішим процесом є коагуляція гідрофобних золей електролітами. Коагулювальну дію електролітів пов'язують зі зменшенням величини електрокінетичного потенціалу, який є одним із головних чинників стійкості гідрофобних золей. Зменшення електрокінетичного потенціалу здійснюється за рахунок витіснення протийонів дифузійного шару в адсорбційний.
Механізм коагуляції за М.Смолуховським таки1: структурні одиниці колоїдної системи - міцели, частинки першого порядку, зіткнувшись і подолавши розклинюючий тиск, утворюють частинку другого порядку. Вона об'єднується ще з однією частинкою першого порядку і утворює частинку третього порядку, що знову приєднує частинку першого порядку і перетворюється в частинку четвертого порядку і т.д. М.Смолуховський довів, що приєднання частинок першого порядку переважає над процесом з'єднання частинок високих порядків.
При коагуляції золів електролітами були виявлені такі правила.
1.Будь-який електроліт може викликати коагуляцію будь-якого золю. Причому, до коагуляції приводять йони, що мають заряд, протилежний заряду гранули, тобто коагуляцію додатньо заряджених золей викликають аніони, а від'ємно заряджених - катіони.
2.Для кожного електроліту існує порогова концентрація, що викликає коагуляцію золю. Поріг коагуляці (порогова концентрація) - це та мінімальна кількість електроліту, яку необхідно додати до одного літра золю, щоб викликати його коагуляцію. Величина, обернена до
порогу коагуляції, називається ко а гу лю ва ль но ю з да т н істю еле ктр о лі ту чи йону.
Протікання коагуляції може бути визначено за ознаками - зміні забарвлення золю, появі каламуті, випаданню осаду.
3.Коагулювальна здатність йонів залежить від величини їх зарядів й за правилом Шульце-Гарді (правило значності) - зі збільшенням
зарядів йону зростає пропорційно шостим степеням величини зарядів йонів, що призводять до коагуляції золю: 16 : 26 : 36. Для різних колоїдних систем співвідношення різне.
4.Йони, які мають однаковий заряд, також відрізняються за коагулювальною дією, що визначається їх радіусом і здатністю до гідратації. Чим більший радіус йона і менша його ступінь гідратації, тим більша коагулювальна дія. Згідно величини коагулювальної здатності катіони та аніони утворюють ліотропні ряди:
P(Cs+)>P(Rb+)>P(K+)>P(Na+)>P(Li+)
P(Ba2+)>P(Sr2+)>P(Ca2+)>P(Mg2+)
P(CN–)>P(I–)>P(Br–)>P(Cl–)
Значну коагулювальну дію мають гідроксид-йони та йони гідроксонію, тому зміна рН золю також суттєво впливає на його стійкість.
5. Коагулювальна здатність багатьох органічних речовин набагато вища, ніж неорганічних, що пов'язано з їх високою адсорбційною здатністю. У гомологічних рядах електролітів з органічними йонами коагулювальна здатність збільшується пропорційно числу СН2 - груп.
У природі частіше зустрічається коагуляція золів сумішами електролітів. Це явище також має свої закономірності. Найчастіше спостерігаються три граничних випадки - адитивність,антагонізм, синергізм коагулювальної дії йонів.
Ади ти вн іс ть д ії електролітів - це сумування їх дії. Такі випадки можливі тільки для електролітів з одинаковим зарядом йонів, близьких за розміром і ступенем гідратації. Для коагуляції золю кожного електроліту треба брати стільки ж як і суміші.
Коли коагулювальна дія одного електроліту зменшується іншим, має місце а нта го ні зм д ії . Тоді кожного електроліту зокрема треба взяти більше, ніж суміші. Пояснюється це хімічною взаємодією між електролітами.
Явище підсилення коагулювальної дії одного електроліту іншим називають си нер гі з мо м дії . Тоді суміші електролітів треба взяти менше, ніж кожного електроліту. Пояснюється це утворенням
високозарядних комплексних йонів, що, згідно правилу значності, мають значно більшу коагулювальну дію.
Явище,що виникає при злитті два колоїдних розчини, гранули яких протилежно заряджені, називають в за є м но ю ко а гу ля ц іє ю зо лі в . Можна спостерігати при переливанні хворому навіть одногрупової крові, приготуванні молочно-фруктових сумішей дієтичного харчування, при змішуванні лікарських форм, фарб. Явище взаємної коагуляції використовують при очистці природних і промислових вод. На водопровідних станціях перед надходженням води на фільтри, до неї додають алюмінію сульфат або ферум (III) хлорид. У результаті гідролізу утворюються додатньо заряджені золі А1(ОН)3 або Fе(ОН)3, які викликають швидку коагуляцію від'ємно ааряджених частинок ґрунту, мікрофлори, органічних сполук.
Всі біологічні рідини організму - кров, плазма, лімфа, сеча та інші, є колоїдними системами, в яких можуть проявлятися коагуляційні явища. Добре дослідженим є процес згортання крові, що забезпечує мінімальну втрату крові і викликає утворення тромбів у кровоносній системі. Природу процесу згортання крові необхідно врахувати при її консервуванні та переливаннях.
Колоїдний захист
Розчини високомолекулярних сполук є істинними, тому термодинамічно стійкими. Якщо до гідрофобного золю додати певну кількість розчину ВМС, то внаслідок адсорбції молекул ВМС на частинках золю, значно зростає його стійкість. Це явище називається ко ло ї д ни м за хи с то м . Найбільша захисна дія відмічається при однойменних зарядах частинок розчинів ВМС. Система стає гідрофільною і набуває стійкості.
Якщо ВМС недостатньо для захисту і в суміші переважає гідрофобний золь, то його частинки можуть адсорбуватись на високомолекулярних речовинах, утворюючи крупні малостійкі агрегати. Це явище називається а ста бі лі за ц ією ко ло ї д но го р о зчи ну .
Явище колоїдного захисту має фізіологічне значення оскільки ряд гідрофобних колоїдів в крові і біологічних розчинах захищені білками чи вуглеводами від коагуляції. Так білки крові стабілізують ліпіди, холестерин та ряд інших гідрофобних речовин. Зниження ступеню цього захисту (з віком чи при порушенні обміну речовин) приводить до відкладання, наприклад, холестерину та сполук кальцію в стінках судин (атеросклероз, кальциноз), утворення каменів в нирках, печінці, протоках травних залоз.
Здатність крові утримувати у зв'язаному стані велику кількість газів (кисню і вуглекислого газу) також зумовлена захисною дією білків. У даному випадку білки обволікають мікробульбашки цих газів і запобігають злиттю.
Явище колоїдного захисту часто використовують при виготовленні ліків, якщо їх треба використовувати в дисперсному стані. Прикладом таких фармакологічних препаратів, що мають антисептичні властивості, є колларгол і протаргол - золі колоїдного срібла, захищені білками та декстрином.
Інструкція для лабораторно-практичної роботи 1. Одержання гідрофобних золів.
1.1. Одержання золю ферум (ІІІ) гідроксиду гідролізом солей феруму. У конічній колбі ємністю 75 мл нагрівають до кипіння 50 мл дистильовані води і в киплячу воду поступово додають із піпетки 5 мл 5%-вого розчину ферум (III) хлориду. Одержують золь ферум (III) гідроксиду чайно-червоного кольору.
Рівняння реакцій: FеСl3 + 3Н2О Fе(ОН)3 + 3НСl
Fе(ОН)3 + НСl FеОСl + 2Н2О стабілізатор
Формула міцели: {m[Fe(OH)3] nFeO+ 3(n-x)Cl–} xCl–.
1.2. Отримання золю ферум гідроксиду методом пептизації.Змішують у стакані 50 ми дистильованої води і 2 мл 5%- вого розчину ферум (ІІІ) хлориду. До одержаного розчину поступово із піпетки додають 5%-вий розчин амоніаку до повного осадження ферум (ІІІ) гідроксиду. Осад відстоюють і обережно зливають надосадову рідину. До осаду додають 30 мл дистильованої води, перемішують, відстоюють рідину, знову зливають. Таку операцію промивання повторюють тричі. Промитий осад розділяють на дві пробірки. У першу з них додають 5 мл дистильованої води, у другу - 3 мл води і 2 мл 5%- вого ферум (ІІІ) хлориду.
Рівняння реакції: FеСl3 + 3NН4ОН Fе(ОН)3 + 3NН4Сl Формула міцели: {m[Fе(ОН)3] nFе3+ 3(n-х)Сl–}3х+хСl.
2. Визначення знаку заряду колоїдних частинок методом капілярного аналізу. Стінки капілярів фільтрувального паперу (целюлоза) заряджені негативно, а вода, яка змочує фільтр - позитивно. На листок фільтрувального паперу наносять краплі, одержаних в дослідах 1.1 і 1.2 золів. Після всмоктування краплі золю з додатною гранулою, адсорбуючись на
