
- •Міністерство України з питань надзвичайних ситуацій та у справах захисту населення від наслідків Чорнобильської катастрофи
- •Хімія, як наука про речовини, їх перетворення і явища, що супроводжують ці перетворення
- •Основні закони хімії.
- •Склад речовини можна виразити за допомогою хімічної формули, яка показує кількісний і якісний склад, а також одну молекулу речовини. Наприклад:
- •Періодична система елементів і будова атома
- •Якщо провести аналогію між будовою електронної оболонки атома і положенням елемента в системі, можна зробити цікаві висновки.
- •Хімічний зв’язок і будова молекул
- •Механізми утворення ковалентного зв’язку
- •Напрямленість ковалентного зв’язку
- •Гібридизація атомних електронних орбіталей
- •Метод молекулярних орбіталей
- •Водневий зв’язок
- •Металічний зв’язок
- •Контрольні завдання
- •Загальні закономірності хімічних процесів
- •Необоротні і оборотні хімічні реакції. Хімічна рівновага в гомогенних і гетерогенних системах.
- •Контрольні завдання
- •Модуль 3
- •3) Дифузія – рівномірний розподіл сольватованих частинок в розчиннику – цей процес супроводжується поглинанням теплоти.
- •Константа є сталою при даній температурі величиною і називається іонним добутком води.
- •Реакції обміну в розчинах електролітів. Іонні рівняння.
- •Контрольні завдання
- •Контрольні завдання
Основні закони хімії.
Із вчення про атоми і молекули випливає закон сталості складу, який відкрив французький хімік Пруст, що можна сформулювати так: кожна індивідуальна молекулярна сполука має сталий якісний і кількісний склад незалажно від способу її добування. Нприклад, розглянемо склад карбон диоксиду СО2 (вуглекислий газ). Ця молекула складається з карбону і оксигену – якісний склад. Вміст карбону – 27,27%, оксигену – 72,73% (або один атом карбону і два атоми оксигену)- кількісний склад. В усіх випадках хімічно чистий крабон диоксид матиме зазначений вище склад, незалежно від способу його добування.
Склад речовини можна виразити за допомогою хімічної формули, яка показує кількісний і якісний склад, а також одну молекулу речовини. Наприклад:
2Н2 індекс Індекс показує кількість атомів елементу, що входять до
складу молекули. Коефіцієнт показує кількість окремих атомів
коефіцієнт або молекул.
Найважливішою характеристикою атома і молекули є їх маса. Сучасні методи дослідження дають можливість визначити надзвичайно малі маси атомів з великою точністю, але застосовувати їх в повсякденній практиці і хімічних розрахунках незручно. В зв’язку з цим була введена особлива одиниця - атомна одиниця маси (а.о.м.), яка дорівнює 1/12 частині маси атома карбону.
1 а.о.м. = 1/12 mAC = 1,667.10-24г = 1,667.10-27 кг.
Величина, одержана в результаті порівняння мас атомів хімічних елементів з 1/12 частиною маси атома карбону, є безрозмірною і називається відносною атомною масою елемента і позначається Аr (r – relative).
Відносну молекулярну масу речовини визначають різними експериментальними методами. За формулою речовини, відносну молекулярну масу обчислюють додаванням відносних атомних мас елементів
Mr =Ar(E1)n1+ Ar(E2)n2+ Ar(E3)n3 + ….
За хімічною формулою і відносною молекулярною масою речовини можна обчислити масову частку елемента у речовині. Масова частка елемента у речовині () показує, яку частину складає маса атомів елементу від маси молекули речовини:
(E) = Ar(E)n .
Mr
Кількість речовини – це фізична величина, яка показує число структурних елементів (атомів, молекул, йонів, електронів і ін) в системі. Кількість речовини позначають грецькою літерою . Одиницею кількості речовини є моль.
Моль – кількість речовини, яка містить стільки частинок (атомів, молекул і ін.), скільки міститься атомів в 12 грамах вуглецю. А скільки атомів міститься в 12 г. вуглецю?
![]() ;
;
![]()
![]()
![]() .
.
Число NA= 6,02.1023 моль-1 називається сталою Авогадро. Отже, 1 моль речовини містить 6,02.1023 частинок. Застосовуючи поняття “моль” необхідно вказувати про які структурні одиниці йде мова.
1 моль атомів гідрогену 1 моль Н
1 моль газоподібного водню 1 моль Н2
Молярна маса М – це маса одного моль речовини. Чому дорівнює молярна маса?
М = маса молекули
х число молекул в 1 моль. Маса однієї
молекули дорівнює Мr
=![]() ,
звідкиmмол
= Мr
.1,66.10-24;
,
звідкиmмол
= Мr
.1,66.10-24;
M
= Mr.1,66.10-24.
6,02.1023моль-1=Мr.1
г/моль![]()
![]()
M
= Мr.1
г/моль![]()
![]()
Молярна маса чисельно дорівнює відносній молекулярній масі.
Стехіометричні закони – закони хімії, які описують вагові і об’ємні співвідношення між реагуючими речовинами. До них відносять: Закон сталості складу, закон збереження маси речовини, закони Авогадро та інші.
Відомо, що в газах при малих тисках відстані між молекулами в тисячи разів більше ніж розміри самих молекул. Тому об’єм газів визначається головним чином кількістю молекул і відстанню між молекулами. При однакових тиску і температурі відстань між молекулами в різних газах приблизно однакові. У 1811 році італійський вчений А.Авогадро сформулював закон: в рівних об’ємах різних газів при однакових умовах міститься однакова кількість молекул. Авогадро також показав, що молекули газів – простих речовин складаються з двох атомів (Н2, О2, Сl2).
Як уже
з’ясовано,
моль будь якої речовини містить 6,02.1023
молекул. Із закону Авогадро випливає,
що 6,02.1023
молекул будь-якого газу при однакових
умовах будуть займати однаковий об’єм.
Можна розрахувати, який об’єм
буде займати 1 моль різних газів при
нормальних умовах (н.у. – атмосферний
тиск 760 мм ртутного стовпа і температура
О0С).
Цей об’єм
можна обчислити за формулою
![]() ,
де М – молярна маса;
- густина газу (тобто маса 1 л газу при
н.у.). Наприклад:
(Н2)
= 0,09 г/л;
(О2)
= 1,43 г/л(О2);
,
де М – молярна маса;
- густина газу (тобто маса 1 л газу при
н.у.). Наприклад:
(Н2)
= 0,09 г/л;
(О2)
= 1,43 г/л(О2);
(N2 ) = 1,25 г/л.
Обчислимо об’єм цих газів за формулою:
V(H2)=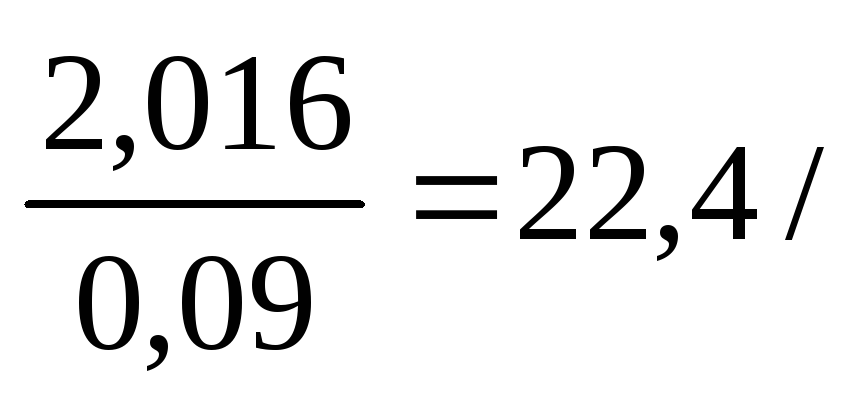 л/моль;
V(O2)
=
л/моль;
V(O2)
=
![]() л/моль;
V(N2)
=
л/моль;
V(N2)
=
![]() л/моль.
л/моль.
І наслідок закону Авогадро: об’єм газу, який займає моль будь-якого газу при нормальних умовах, називається молярним об’ємом. Молярний об’єм будь-якого газу при нормальних умовах дорівнює 22,4 л/моль.
ІІ наслідок закону Авогадро: відносна густина одного газу по іншому дорівнює відношенню густини першого газу до густини другого газу.
D
=
![]() ;
оскільки
;
оскільки
![]() ,
то D
=
,
то D
=
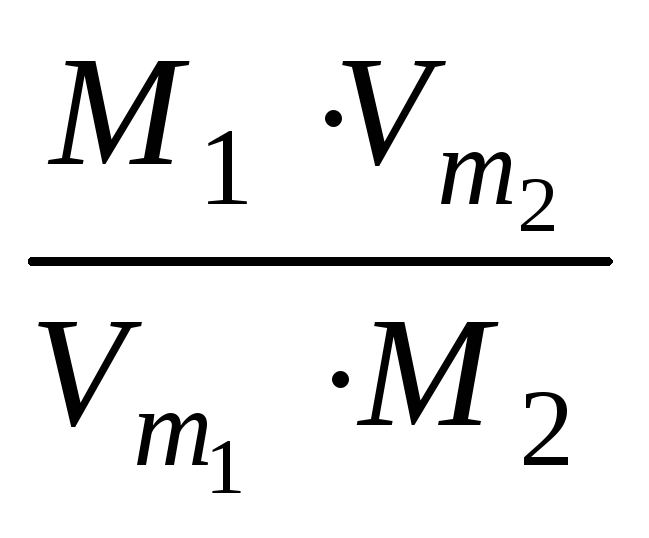 .
.
Згідно
з першим наслідком закону Авогадро, при
однакових умовах молярний об’єм
різних газів однаковий, отже
![]() ,
тому
,
тому
D
=
![]() .
Висновок: відносна густина одного газу
по іншому дорівнює відношенню їх молярних
мас (обо відносних молекулярних мас).
Найчастіше відносну густину газу
визначають за воднем або за повітрям
.
Висновок: відносна густина одного газу
по іншому дорівнює відношенню їх молярних
мас (обо відносних молекулярних мас).
Найчастіше відносну густину газу
визначають за воднем або за повітрям
D(H2)
=
![]() ;
D(повітря)=
;
D(повітря)=![]() .
.
29 – це середня молярна маса повітря. Оскільки повітря складається з 4 об’ємів азоту і 1 об’єму кисню, то:
М(повітря)
=
![]() =
28,8~29
г/моль.
=
28,8~29
г/моль.
Відносна
густина показує, у скільки разів один
газ важче за інший. Наприклад, відносна
густина кисню за воднем дорівнює 16,
D(H2)=![]() =
16.Отже,
кисень важче за водень у 16 разів.
=
16.Отже,
кисень важче за водень у 16 разів.
Один з основних законів хімії – закон збереження маси речовин – відкритий і експериментально підтверджений великим російським вченим М.В.Ломоносовим у 1748 р. Цей закон можна сформулювати так: в ізольованій системі маса речовин, що вступилив реакцію, дорівнює масі речовин, що утворилися внаслідок реакції. Закон збереження маси речовини є приватним випадком загального закону природи – закону збереження матерії і руху. У 1789 році французький хімік Лавуазьє підтврдив експериментально закон збереження маси речовин і зробив висновок, що під час хімічних реакцій маса кожного атому не змінюється, тому і загальна маса речовин не змінюється. Закон збереження маси речовин лежить в основі кількісих розрахунків хімічних реакцій, і обумовлений тим, що при хімічній взаємодії атоми не зникають і не виникають.
Хімічне рівняння – це вираз хімічної реакції за допомогою хімічних формул. Ліва частина хімічного рівняння містить формули речовин, які вступають в реакцію – вихідні речовини. Права частина хімічного рівняння містить речовини, які утворилися в результаті реакції (продукти реакції).
Наприклад, схема горіння магнію: Mg + O2 MgO.
Згідно закону збереження маси речовин, кількість атомів кожного елементу в лівій і правій частинах рівняння повинно бути однаковим. Для цього ставлять коефіцієнти. Таким чином, хімічне рівняння горіння магнію в кисні потрібно записати так:
2Mg + O2 = MgO
2. 24=48 + 16.32=32 2(24+16)=80
80
Якщо правильно розуміти, що приховується за символами і формулами, хімічне рівняння може дати надзвичайно широку інформацію про реакцію. Наприклад, рівняння 2Н2 + О2 = 2Н2О показує, що реакція протікає між простими речовинами воднем і киснем. В результаті утворюється складна речовина – вода. Це якісна інформація. Рівняння дає і кількісну характеристику процесу: в реакцію вступає дві молекули водню і одна молекула кисню. Число молекул, які прийняли участь в реакції, показує коефіцієнт перед формулою речовини. Оскільки моль будь-якої речовини містить однакову кількість молекул, наведене рівняння може дати і інформацію щодо кількості речовини: два моль водню взаємодіють з одним моль кисню і утворюється два моль води. Знаючи молярні маси реагуючих речовин, рівняння можна прочитати і так: 4 г водню вступає в реакцію з 32 г кисню і утворюється 36 г води. Нарешті, оскільки в реакцію вступають газоподібні речовини і враховуючи, що однакова кількість речовини займає однаковий об’єм, можна зробити висновок, що 2 об’єма водню взаємодіють з 1 об’ємом кисню, утворюючи два об’єми водяних парів. Вся ця інформація дозволяє використовувати хімічні рівняння для виконання різних хімічних розрахунків.
2Н2 + О2 = 2Н2О
n=2моль 1 моль 2 моль
М=2.2г/моль 32 г/моль 2.18 г/моль
m= 4г 32 г 36 г
V= 2.22,4=44,8л 22,4 л 2.22,4 =44,8 л
У 1869
роцi![]() росiйський
вчений Д.I.Менделєєв вiдкрив перiодичний
закон.
росiйський
вчений Д.I.Менделєєв вiдкрив перiодичний
закон.
Властивостi елементiв i iх сполук знаходяться в перiодичнiй залежностi вiд атомних мас елементiв. Перiодичний закон – це основний закон хімії.
Перiодична система - це графiчне зображення перiодичного закону. З будовою періодичної системи ми познайомилися на минулій лекції. (Актуалізація попередніх знань)
Крім груп і підгруп у періодичній системі є ряди подібних елементів, які розташовані в одній і тій самій групі і в одному періоді. Ці ряди елементів називаються родинами . Так, до родини заліза належать залізо, кобальт і нікель; до платинових металів входить шість елементів (Ru, Rh, Pd, Os, Ir, Pt), до родини лантаноїдів – елементи з порядковими номерами 57-71, які дуже подібні між собою, родина актиноїдів містить чотирнадцять елементів з порядковими номерами 90-103, що йдуть за актинієм і дуже подібні між собою за властивостями. Лантаноїди та актиноїди здебільшого виносять у самостійні ряди, які розташовують внизу періодичної системи елементів.
В періодичній системі властивості елементів, їхні атомні маси, валентність, хімічний характер змінюються як у групах, так і в періодах в певній послідовності. Знаючи положення елемента в таблиці, можна досить точно визначити його властивості.
