
- •1. Общая характеристика и химические свойства щелочных металлов.
- •2. Особенности соединений бериллия по сравнению с соединениями щелочно-земельных металлов.
- •3. Общая характеристика и химические свойства бора, его получение.
- •4. Общая характеристика и химические свойства алюминия, индия, галлия и таллия.
- •5. Общая характеристика и химические свойства углерода.
- •6. Общая характеристика и химические свойства кремния.
- •7. Общая характеристика и химические свойства германия, олова и свинца.
- •Получение
- •Химические свойства
- •Получение
- •Химические свойства
- •9. Общая характеристика и химические свойства фосфора его получение в промышленности.
- •10. Общая характеристика и химические свойства мышьяка, сурьмы и висмута.
- •11. Получение кислорода и пероксида водорода в промышленности и в лаборатории.
- •12. Общая характеристика и химические свойства серы, селена и теллура.
- •13. Получение водорода в промышленности.
- •14. Общая характеристика и химические свойства галогенов.
- •14. Фториды ксенона: получение, строение молекул и химические свойства.
- •15. Общая характеристика и химические свойства меди, серебра, золота.
- •16. Общая характеристика и химические свойства элементов подгруппы цинка.
- •17. Общая характеристика и химические свойства подгруппы скандия.
- •18. Общая характеристика и химические свойства металлов подгруппы титана.
- •19. Общая характеристика и химические свойства элементов подгруппы ванадия.
- •20. Общая характеристика и химические свойства хрома, молибдена и вольфрама.
- •21. Общая характеристика и химические свойства марганца, технеция и рения.
- •22. Общая характеристика и химические свойства железа, кобальта и никеля.
- •23. Общая характеристика и химические свойства платиновых металлов.
- •26. Получение железа, никеля, хрома и марганца в промышленности.
- •27. Пирометаллургические способы получения металлов (свинец, медь, цинк) из сульфидных руд.
- •28. Окислительное действие нитрата калия и хлората калия при нагревании (сплавлении).
- •29. Образование аммиакатов и гидроксокомплексов металлов и их разрушение кислотами и при нагревании.
- •30. Реакции термического разложения некоторых кислых солей ( NaHco3, NaH2po4, Na2hpo4, NaHso4).
- •31. Гидролиз солей (по катиону, по аниону, одновременный гидролиз двух солей).
28. Окислительное действие нитрата калия и хлората калия при нагревании (сплавлении).
Хлораты калия, натрия
4KClO3=(t)=KCl+ 3KClO42KClO3=(t,MnO2)= 2KCl+ 3O2
Примеры окислительной активности хлоратов
KClO3 + 3Mg =(t)= KCl + 3MgO NaClO3 + 5NaCl + 3H2SO4 = 3Na2SO4 + 3Cl2 + 3H2O
29. Образование аммиакатов и гидроксокомплексов металлов и их разрушение кислотами и при нагревании.
Аммиакаты: Аммиачные комплексы обычно получают при взаимодействии солей или гидроксидов металлов с аммиаком в водных или неводных растворах, либо обработкой тех же солей в кристаллическом состоянии газообразным аммиаком:
AgCl(т) + 2 NH3 . H2O = [Ag(NH3)2]Cl + 2 H2O
Cu(OH)2(т) + 4 NH3 . H2O = [Cu(NH3)4](OH)2 + 4 H2O
NiSO4 + 6 NH3 . H2O = [Ni(NH3)6]SO4 + 6 H2O
CoCl2 + 6 NH3(г) = [Co(NH3)6]Cl2
Разрушение [Ag(NH3)2]+ + 2Н+ → Ag+ + 2NH4+,
[Ni(NH3)6]SO4 + 3 H2SO4 = NiSO4 + 3 (NH4)2SO4
Водный раствор аммиака при взаимодействии с ионами меди (II) сначала осаждает основные соли переменного состава зеленого цвета, легкорастворимые в избытке реагента. При этом образуется аммиачный комплекс меди сине-фиолетового цвета: Cu2++ 4NH4OH = [Cu(NH3)4]2++ 4H2O
Гидроксокомплексы металлов: Men++ mOH–= [Me(OH)m]n-m
Гидроксокомплексы образуются в реакциях протолизаиз аквакомплексов:
[Al(H2O)6]3+
+ H2O
![]() [Al(H2O)5(OH)]2+
+ H3O+
[Al(H2O)5(OH)]2+
+ H3O+
либо при растворении амфотерных гидроксидовв водных растворах гидроксидов щелочных металлов:
Zn(OH)2 + 2 OH = [Zn(OH)4]2
При рассмотрении способов разрушениягидроксокомплексовможно выделить несколько случаев.
1) При действии избытка сильной кислоты получаются две средних соли и вода:
Na[Al(OH)4] + 4HCl (изб.) = NaCl + AlCl3 + 4H2O,
K3[Cr(OH)6] + 6HNO3 (изб.) = 3KNO3+ Cr(NO3)3+ 6H2O.
2) При действии сильной кислоты (в недостатке) получаются средняя соль активного металла, амфотерный гидроксид и вода:
Na[Al(OH)4]
+ HCl = NaCl + Al(OH)3![]() + H2O,
+ H2O,
K3[Cr(OH)6]
+ 3HNO3 =
3KNO3
+ Cr(OH)3![]() + 3H2O.
+ 3H2O.
3) При действии слабой кислоты получаются кислая соль активного металла, амфотерный гидроксид и вода:
Na[Al(OH)4]
+ H2S
= NaHS + Al(OH)3![]() + H2O,
+ H2O,
K3[Cr(OH)6]
+ 3H2CO3
= 3KHCO3 +
Cr(OH)3![]() + 3H2O.
+ 3H2O.
30. Реакции термического разложения некоторых кислых солей ( NaHco3, NaH2po4, Na2hpo4, NaHso4).
2NaHCO3 =(t) Na2CO3 + CO2+ H2O
NaH2PO4=(t) NaPO3 + H2O
2Na2HPO4=(t) Na4P2O7 + H2O
2NaHSO4=(t) Na2S2O7 + H2O
31. Гидролиз солей (по катиону, по аниону, одновременный гидролиз двух солей).
Поляризационное взаимодействие катионов и анионов с сильно полярными молекулами воды ведет к особой химической реакции ионного обмена, называемой гидролизом солей.
Качественную и количественную стороны гидролиза удобно рассматривать с позиции концепции сильных и слабых электролитов (неассоциированных и ассоциированных). Практически все электролиты, относящиеся к категории слабых в водных растворах, характеризуются тем, что равновесие их диссоциации смещено влево, в сторону недиссоциированных частиц. Иными словами, для них характерна не диссоциация, а наоборот – ассоциация, то есть связывание соответствующими анионами протонов, катионами – ионов ОН-в недиссоциированные частицы. А ионы Н+и ОН-всегда имеются в воде за счет незначительной диссоциации. Рассмотрим более подробно происходящие процессы на примерах двух солей – СuCl2иNa2CO3.
Хлорид меди (II) является сильным электролитом, поэтому в водном растворе полностью диссоциирует на ионы:
СuCl2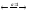 Cu2++ 2Cl-
Cu2++ 2Cl-
Гидроксид меди (II) относится к слабым электролитам, иными словами катионCu2+при наличии в растворе ионов ОН-будет активно связывать их в малодиссоциированную частицуCuOH+, нарушая тем самым равновесие диссоциации воды:
Н2ОН++ ОН-
Cu2++H2OCuOH++H+
В результате, согласно принципу Ле Шателье, усилится диссоциация воды и в растворе увеличится концентрация ионов водорода по сравнению с той, которая была в воде. Раствор становится кислым, его рН7, подобная ситуация называетсягидролизом по катиону.
Разумеется, гидролиз хлорида меди может идти и дальше, по второй ступени:
CuOH+ + H2O Cu(OH)2 + H+
Однако, принимая во внимание то, что продукты гидролиза по первой ступени подавляют вторую ступень и то, что поляризационное взаимодействие ионаCu2+с молекулами воды несравненно сильнее, чем ионаCuOH+, приходим к следующему важному выводу. При наличии возможности протекания ступенчатого гидролиза, этот процесс реально протекает лишь по первой ступени.
Сходная ситуация возникает и в растворе Na2CO3. В результате полной диссоциации этой соли в растворе образуются ионы СО32-, являющиеся анионами слабой угольной кислоты. Этот ион при наличии в растворе протонов будет активно связывать их в малодиссоциированную частицу НСО3-, нарушая тем самым равновесие диссоциации воды:
Н2ОН++ ОН-
СО32-+ Н2ОНСО3-+ ОН-
В результате усилится диссоциация воды и в растворе увеличится концентрация ионов ОН-по сравнению с той, которая была в воде. Раствор стал щелочным, его рН>7, в этом случае говорят огидролизе по аниону.
Поляризационное взаимодействие катионов и анионов с сильно полярными молекулями воды ведет к реакции, наз. гидролизом солей.
Гидролиз соли по катиону и по аниону одновременно можно представить в общем виде следующим образом:
Kt++A-+H2O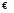 KtOH+HA
KtOH+HA
