
- •1. Общая характеристика и химические свойства щелочных металлов.
- •2. Особенности соединений бериллия по сравнению с соединениями щелочно-земельных металлов.
- •3. Общая характеристика и химические свойства бора, его получение.
- •4. Общая характеристика и химические свойства алюминия, индия, галлия и таллия.
- •5. Общая характеристика и химические свойства углерода.
- •6. Общая характеристика и химические свойства кремния.
- •7. Общая характеристика и химические свойства германия, олова и свинца.
- •Получение
- •Химические свойства
- •Получение
- •Химические свойства
- •9. Общая характеристика и химические свойства фосфора его получение в промышленности.
- •10. Общая характеристика и химические свойства мышьяка, сурьмы и висмута.
- •11. Получение кислорода и пероксида водорода в промышленности и в лаборатории.
- •12. Общая характеристика и химические свойства серы, селена и теллура.
- •13. Получение водорода в промышленности.
- •14. Общая характеристика и химические свойства галогенов.
- •14. Фториды ксенона: получение, строение молекул и химические свойства.
- •15. Общая характеристика и химические свойства меди, серебра, золота.
- •16. Общая характеристика и химические свойства элементов подгруппы цинка.
- •17. Общая характеристика и химические свойства подгруппы скандия.
- •18. Общая характеристика и химические свойства металлов подгруппы титана.
- •19. Общая характеристика и химические свойства элементов подгруппы ванадия.
- •20. Общая характеристика и химические свойства хрома, молибдена и вольфрама.
- •21. Общая характеристика и химические свойства марганца, технеция и рения.
- •22. Общая характеристика и химические свойства железа, кобальта и никеля.
- •23. Общая характеристика и химические свойства платиновых металлов.
- •26. Получение железа, никеля, хрома и марганца в промышленности.
- •27. Пирометаллургические способы получения металлов (свинец, медь, цинк) из сульфидных руд.
- •28. Окислительное действие нитрата калия и хлората калия при нагревании (сплавлении).
- •29. Образование аммиакатов и гидроксокомплексов металлов и их разрушение кислотами и при нагревании.
- •30. Реакции термического разложения некоторых кислых солей ( NaHco3, NaH2po4, Na2hpo4, NaHso4).
- •31. Гидролиз солей (по катиону, по аниону, одновременный гидролиз двух солей).
14. Фториды ксенона: получение, строение молекул и химические свойства.
Фториды ксенона
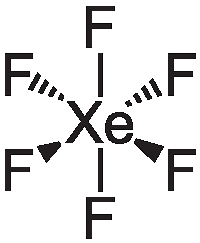
Xe + PtF6 = Xe[PtF6]
Xe + F2 = (XeF2;XeF4;XeF6) в зависимости от соотношений, температуры и давления
XeF6 + BF3 = XeF6*BF3
XeF2 + 2SbF5 = Xe[SbF6]2
XeF6 + CsF = Cs[XeF7]
Гидролиз:
2XeF2 + 2H2O = O2 +2Xe +4HF
XeF4 + 2H2O = O2 +Xe +4HF
XeF6 + H2O = XeoF4 + 2 HF
XeOF4 + H2O = XeO2F2 + 2HF
XeO2F2 + H2O = XeO3 + 2HF
Р-ции присоединения:
XeF2 + 2SbF5 = Xe[SbF6]2 XeF6 + CsF = Cs[XeF7]
Р-ции диспропорционирования:
3XeF4 =(H2o)= 2XeF6 + Xe 3XeF6 =(t)= XeF2 + 2XeF8 (полный гидролиз)
Получающийся при полном гидролизе XeF6 кристаллический XeO3 чрезвычайно легко и мощно взрывается.
Получение ксенатов:
XeO3 + KOH = KHXeO4
XeO3 + 3Ba(OH)2 = Ba3XeO6 + 3H2O
Перксенаты:
2KHXeO4 + 2KOH = K4XeO6 + Xe +O2 + 2H2O
15. Общая характеристика и химические свойства меди, серебра, золота.
Природные источники и получение:
Медные соединения преимущественно представлены сульфидами : Cu2S-халькозин, CuFeS2-халькопирит,так же представляет интерес для переработки Cu2(OH)2CO3-малахит.
2Cu2S + 3O2= 2Cu2O + 2SO2 2Cu2O + Cu2S= 6Cu + SO2
Серебро также встречается в виде сульфидов,например, Ag2S-аргентит.Ag выделяют из неочищенных Cu,Pb и других металлов,в рудах которых содержится его примеси.
Золото в основном представлено в природе в самородном виде.Кроме механического способа отделения золота от песка, основанного на большой разности плотности этого металла и SiO2, Au получают амальгамированием или цианидным способом(метод П.Р.Багратиона):
4Au + 8KCN + O2 + 2H2O = 4K[Au(CN)2] + 4KOH
2K[Au(CN)2] + Zn = K2[Zn(CN)4] +2Au
Химические свойства:
В атомах элементов Сu, Ag, Au происходит «провал» s-электрона, приводящий к полному заполнению электронами d-орбиталей. Благодаря наличию одного s-электрона во внешнем слое для этих элементов характерна степень окисления +1.Кроме того возможны ст.ок. +2 +3 для меди,+2 для серебра, +3 +5 для золота.Эти металлы обладают наивысшей тепло- и электропроводностью, ковки и пластичны.Не реагируют с водой и не вытесняют водород из растворов минеральных кислот,т.к. электродные потенциалы этих металлов имеют положительные значения.Пассивны при комнатной температуре, наибольшей активностью отличается медь.
Cu + 4HNO3(конц) = Cu(NO3)2 + 2NO2 +2H2O
3Cu + 8HNO3(разб) =3Cu(NO3)2 + 2NO + 4H2O
Cu + 2H2SO4(конц) = CuSO4 + SO2 + 2H2O
Ag + 2HNO3(конц) =AgNO3 + NO2 + H2O
2Ag + 2H2SO4(конц) =t= Ag2SO4 + SO2 + 2H2O
3Ag + 4HNO3(разб) = 3AgNO3 + NO + 2H2O
Au же нерастворимо в них, лучшим кислотным растворителем для Au является царская водка:
Au + HNO3 + 4HCl = H[AuCl4] + NO + 2H2O
Так же возможно:
2Au + 2HCl + 3Cl2 = 2H[AuCl4]
2Au + 6H2SeO4(конц) = Au2(SeO4)3 + 3H2SeO3 + 3H2O
2Ag(Cu) + H2S(г) = Ag2S(Cu2S) + H2
Соединения:
Черный CuO:
2Cu + O2 =t= 2CuO
2Cu(NO3)2 =t= 2Cuo + 4 NO2 + O2
Cu2(OH)2CO3 =t= 2CuO + CO2 + H2O
Красный Cu2O:
4CuSO4 + 8NaOH + N2H4 = N2 + 2Cu2O + 4Na2SO4 + 6H2O
Оба оксида проявляют основные свойства,у CuO отмечается слабая амфотерность:
CuO + 2NaOH =спл= Na2CuO2 + H2O
Cu2O + 4NH3 + H2O = 2[Cu(NH3)2]OH
CuO + 4NH3 + H2O = 2[Cu(NH3)4](OH)2
2AgNO3 + 2NaOH = Ag2O + 2NaNO3 + H2O
При обработке озоном образуется черный AgO,сильный окислитель
При приливании растворов щелочей к солям меди +2 осаждается Сu(OH)2- голубой осадок:
Сu(OH)2 + 2NaOH = Na2Cu2O + 2H2O
Cu(OH)2 =t= CuO + H2O
Au(OH)3 – золотисто-желтый:
AuCl3 + 3KOH = Au(OH)3 + 3KCl
Au(OH)3 =50-100С= AuO(OH) + H2O
2AuO(OH) =150C= Au2O3 + H2O
Au(OH)3 + KOH = K[Au(OH)4]
Au(OH)3 + 4HCl = H[AuCl4] + 3H2O
Au2O3 =>150C= Au + Au2O + O2
Cu + CuCl2 + 2HCl = 2H[CuCl2]
CuCl + NaCl(изб) = Na[CuCl2]
CuCl2 + 2NH3(изб) = [Cu(NH3)2]Cl
2CuSO4 + KI = 2K2SO4 + 2CuI +I2
CuSO4 + 4KCN(изб) =K2[Cu(CN)4] + K2SO4
2CuSO4 + 4KCN = 2CuCN + 2K2SO4 + (CN)2
Соли меди +2 сильно гидролизованы
2CuSO4 + 2K2CO3 + H2O = Cu2(OH)2CO3 + 2K2SO4 + CO2
Соли серебра +1 практически не гидролизованы,растворимые соли серебра единичны.
AgF-AgCl-AgBr-AgI растворимость уменьшается
AgCl + NaCl(изб) = Na[AgCl2]
AgCl + 2NH3(изб) = [Ag(NH3)2]Cl
AgBr + 2NH3(изб) = [Ag(NH3)2]Br
AgI уже не растворяется в водном растворе аммиака
AgГ + 2Na2S2O3(изб) = Na3[Ag(S2O3)2] + NaГ
2AgF2 =t=2AgF + 2
4AgF2 + 2H2O = 4AgF +4 HF + O2
H[AuCl4] – золотохлористоводородная к-та
2H[AuCl4] + 3SnCl2 = 3SnCl4 +2Au+2HCl
2Au + 5KrF2=HF(ж)=2AuF5 + 5Kr
2Au + 5KrF2 + 2KF = HF(ж)= 2K[AuF6] + 5 Kr
