
- •Медико-биологический факультет Кафедра биохимии и молекулярной биологии с курсом клинической
- •Микросомальная система окисления состоит из 2 электронтранспортных цепей.
- •Функционирование первой цепи переноса элекрон
- •Ключевым ферментом системы микросомального окисления выступает цитохром Р450 (К.Ф. 1.14.13.1 и 1.14.14.1), представляющий
- •нкционирование второй цепи переноса электронов
- •Метаболизм ксенобиотиков
- •Первая фаза метаболизма ксенобиотиков
- •Тип связывания фермента с субстратом может быть установлен при помощи спектральных методов, поскольку
- •Гидроксилирование
- •Окислительное
- •Окисление по сере и азоту
- •Результатом биотрансформации лекарственных веществ являются:
- •лагодарю за внимание
Медико-биологический факультет Кафедра биохимии и молекулярной биологии с курсом клинической
лабораторной диагностики
Участие цитохрома Р450 в окислении ксенобиотиков
и природных субстратов
Выполнила:
Щербёнок Валентина Сергеевна Студентка 5 курса Группа 4104
Томск ,2015
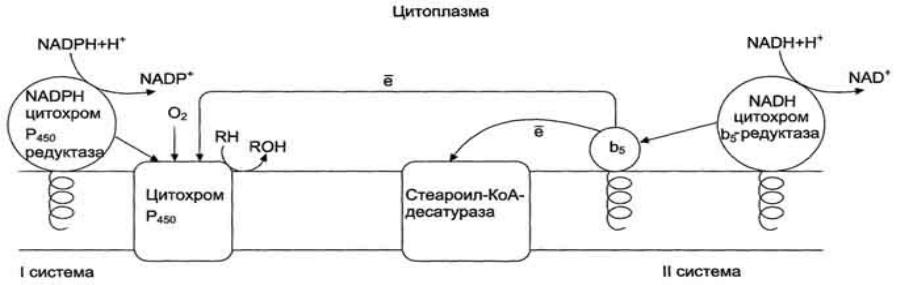
Микросомальная система окисления состоит из 2 электронтранспортных цепей.
•Первая состоит из 2 ферментов: NADPH Р - 450 редуктаза (коферменты ФАД и ФМН) и цитохрома Р-450 (кофермент - железосодержащий гем)
•Вторая включает: NADH –цитохром b5 редуктазу, цитохром b5 и стеароил-КоА –десатуразу.
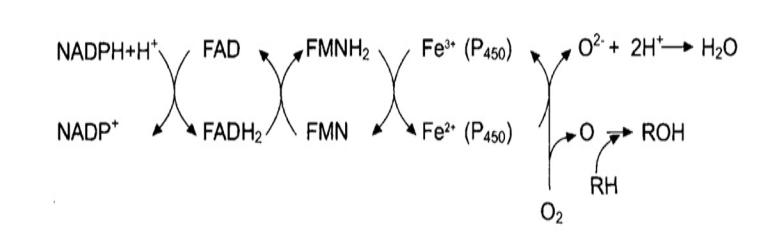
Функционирование первой цепи переноса элекрон
Мультиферментный комплекс формирует цепь переноса электронов и протонов, в конце ее происходит активация кислорода. Активированный кислород присоединяется к активному центру цитохрома Р450, и на него переносятся электроны, а затем этот кислород включается в молекулу субстрата (ксенобиотика).
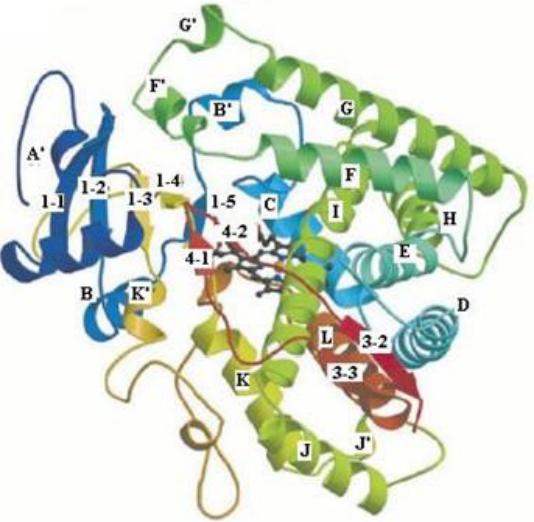
Ключевым ферментом системы микросомального окисления выступает цитохром Р450 (К.Ф. 1.14.13.1 и 1.14.14.1), представляющий собой мономер с молекулярной массой от 44 до 60 kDa и содержащий одну геминную группировку.
Он имеет участки связывания для кислорода и субстрата.
Название цитохром Р450 указывает
на то, что максимум поглощения комплекса цитохрома Р450 лежит в
области 450 нм.
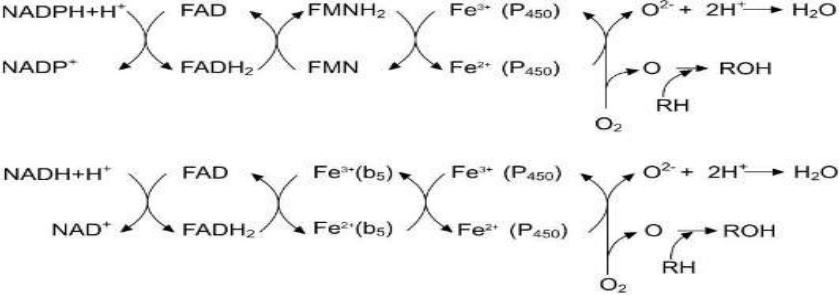
нкционирование второй цепи переноса электронов
Протоны и электроны с NADH переходят на кофермент редуктазы FAD, следующим акцептором электронов служит Fe3+ цитохрома b5. Цитохром b5 в некоторых случаях может быть донором электронов (ē) для цитохрома Р450 или для стеароил-КоА-десатуразы, которая катализирует образование двойных связей в жирных кислотах, перенося электроны на кислород с
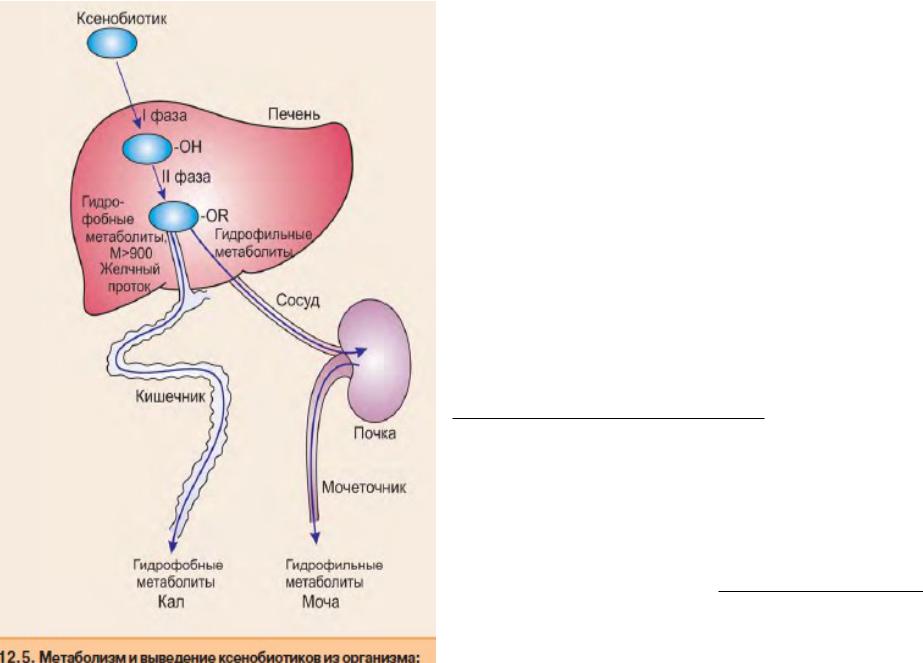
Метаболизм ксенобиотиков
направлен на снижение их активности, а значит и их токсичности. Но иногда метаболиты ксенобиотиков становятся более активными и даже более токсичными.
В метаболизме ксенобиотиков различают три фазы, которые приводят к увеличению гидрофильности молекулы, снижению активности и токсичности.
Первая фаза метаболизма чужеродных веществ заключается в модификации, создающей или высвобождающей функциональные группы, которые во второй фазе конъюгируют с другими группами или молекулами. Третья фаза - связывание и выведение ксенобиотиков и их метаболитов из клетки и из организма. Превращаясь в гидрофильные соединения, часть
ксенобиотиков выделяется с мочой.
Первая фаза метаболизма ксенобиотиков
Три основных реакции:
-Окисление
-Восстановление
-Гидролиз
Микросомальные ферменты катализируют реакции (R – ксенобиотик):
•Гидроксилирование RH → ROH
•Окислительное дезаминирование RNH2 → R=O + NH3
•Дезалкилирование по азоту, кислороду, сере:
•RNHCH3 → RNH2 + H2C=O
•ROCH3 → ROH + H2CO
•RSCH3 → RSH + H2CO
•Окисление по атому серы (сульфоокисление) и др.
Тип связывания фермента с субстратом может быть установлен при помощи спектральных методов, поскольку связывание субстратов с цитохромом Р-450 изменяет его спектральные характеристики.
Измерение спектра |
поглощения цитохрома |
в |
присутствии субстрата |
дает так называемый спектр |
|
различия. Субстраты, которые связываются с белковой частью цитохрома Р-450, имеют «спектр
различия» около 390 нм. Такие субстраты называются субстратами первого типа.
Другая группа субстратов связывается с геминной группировкой цитохрома. Эти субстраты имеют «спектры различия» с максимумом около 420 нм и называются субстратами второго типа.
Гидроксилирование
Один атом кислорода принимает 2 электрона и переходит в форму О2-. Донором электронов служит NADPH, который окисляется NADPH- цитохром Р450 редуктазой. О2- взаимодействует с протонами: О2- +
2Н+→ Н2О, и образуется вода. Второй атом молекулы кислорода
включается в субстрат RH, образуя гидроксильную группу вещества R-OH.
Суммарное уравнение реакции гидроксилирования вещества RH ферментами микросомального окисления:
RH + О2 + NADPH + Н+ → ROH + Н2О + NADP+
Субстратами Р450 могут быть многие гидрофобные вещества как
экзогенного (лекарственные препараты, ксенобиотики), так и эндогенного (стероиды, жирные кислоты и др.) происхождения. Таким образом, в результате первой фазы обезвреживания с участием цитохрома Р450происходит модификация веществ с
образованием функциональных групп, повышающих растворимость гидрофобного соединения. В результате модификации возможна потеря молекулой её биологической активности или даже
Окислительное
дезаминирование.
Отщепление аминогруппы от лекарственных препаратов чаще всего приводит к потере фармакологического эффекта, например окислительное дезаминирование в микросомах печени амфетамина (С6Н5СН2СНNH2CH3) с
образованием фенилацетона (С6Н5СН2СОCH3).
