
- •Основы
- •Главная функция белков - ферментативная (каталитическая).
- •Реакции, катализируемые рибозимами:
- •Избранные факты из истории энзимологии
- •Ферменты – биологические катализаторы, способные многократно изменять скорость метабо- лических реакций.
- •6.Скорость ферментативной реакции пропорцио- нальна количеству фермента.
- •Согласно решению Комиссии по ферментам Между- народного биохимического союза, все известные фер- менты
- •1 класс: ОКСИДОРЕДУКТАЗЫ
- •2 класс: ТРАНСФЕРАЗЫ
- •3 класс: ГИДРОЛАЗЫ
- •4 класс: ЛИАЗЫ
- •5 класс: ИЗОМЕРАЗЫ.
- •6 класс: ЛИГАЗЫ Катализируют присоединение друг к другу двух разных
- •ФЕРМЕНТЫ
- •НЕБЕЛКОВА ЧАСТЬ МОЛЕКУЛЫ СЛОЖНОГО ФЕРМЕНТА
- •Классификация коферментов:
- •Активный (каталитический) центр фермента
- •Химотрипсин: активный (каталитический) центр
- •Активный центр – трехмерное образование. Для некоторых ферментов активный центр имеет форму щели
- •Структура активного центра фермента:
- •Функции аминокислотных остатков, которые не входят в состав активного центра
- •Механизмы ферментативного катализа
- •Механизмы ферментативного катализа
- •Помимо вышеупомянутых механизмов ферментативного катализа, важная роль принадлежит следующим явлениям, которые способствуют снижению
- •3. Механизм «пинг-понг».
- •Двухсубстратные-двухпродуктные ферментативные реакции
- •Двухсубстратные-двухпродуктные реакции протека- ют с образованием двух видов промежуточных комп- лексов. Причина -
- •Пример двухсубстратных-двухпродктных реакций, идущих с образованием замещенной формы фермен- та – реакции, катализируемые
- •Особенность двухсубстратных реакций – кинетика может отклоняться от кинетики Михаэлис-Ментен:
- •Субстратная специфичность ферментов
- •2. Групповая субстратная специфичность.
- •3. Стереоспецифичность.
- •4. Каталитическая субстратная специфичность.
- •Гипотезы, объясняющие механизм субстратной специфичности ферментативного катализа
- •2. Гипотеза Кошланда «Вынужденное соответ- ствие»
- •Зависимость V ферментативной реакции от рН
- •Зависимость V ферментативной реакции от рН
- •Зависимость V ферментативной реакции от рН
- •Зависимость V ферментативной реакции от температуры
- •Энергетика биохимических реакций
- •Энергетика биохимических реакций
- •Энергетика биохимических реакций
- •Влияние фермента на величину энергии активации, Еа
- •Переходное состояние и фермент- субстратный комплекс (ES)
- •Зависимость V реакции от Т
- •Аррениус установил зависимость между константой скорости реакции и энергией активации
- •Ферментативная
- •Одна из характеристик ферментативной реакции:
- •Константа скорости (био)химической реакции k чис- ленно равна скорости реакции при концентрации каждого
- •Реакция второго порядка:
- •В случае тримолекулярных реакций:
- •Единицы активности фермента:
- •Законы ферментативной кинетики. Первые попытки.
- •Исследоания Л. Михаэлис и М. Ментен
- •В 1913 году Л. Михаэлис и М. Ментен вывели уравнение кинетики ферментативной реакции
- •Уравнение Михаэлис – Ментен: [S]
- •Доля молекул фермента,
- •Из графика, построенного на основе уравнения Михаэлис – Ментен, следует:
- •При достижении определенной [S], скорость ферментативной реакции перестает зависить от [S] – достигается
- •График Михаэлис – Ментен имеет вид параболической кривой
- •Способы линеаризации кривой Михаэлис - Ментен:
- •2. График Эди –Хофсти, рубеж 40 и 50-х.
- •3. График Эйзенталя и Корниш-Боудена, 1974 г.
- •Для чего необходимо знать величины
- •Vmax
- •Регуляция
- •ИНГИБИРОВАНИЕ ФЕРМЕНТОВ
- •ИНГИБИТОРЫ
- •Инактиваторы – комплекс химических, биологических, физических факторов, которые способны деструктурировать молекулу фермента. Под
- •Конкурентные (изостерические) ингибиторы, Iк
- •Физический смысл константы ингибирования Ki:
- •Выявление конкурентного типа ингибирования путем построения графика Лайнуивера-Бэрка
- •Влияние конкурентного ингибитора на каталитические свойства фермента
- •Неконкурентные ингибиторы, Iнк
- •Iнк не уменьшает доли Е, связавшегося с S, но снижает число оборотов фермента.
- •Выявление неконкурентного типа ингибирования путем построения графика Лайнуивера-Бэрка
- •Влияние неконкурентного ингибитора на каталитические свойства фермента
- •Выявление смешанного типа ингибирования
- •Бесконкурентные ингибиторы, Iбк
- •Выявление бесконкурентного типа ингибирования путем построения графика Лайнуивера-Бэрка
- •Частный случай бесконкурентного ингибирования – ингибирование субстратом или субстратное торможе- ние.
- •Графические методы определения величины Ki
Энергетика биохимических реакций
Для протекания химической реакции требуется выполнение, по меньшей мере, трех условий:
1. Реакция должна быть термодинамически возможной: проис- ходить спонтанно (самопроизвольно). При этом энергия продукта
(Р) будет меньше энергии субстрата (S). Изменение свободной энергии Гиббса имеет значение – G, то есть химическое превра-
щение идет с отдачей энергии (экзэргонический процесс) в форме химической работы: разрыв одних хим.связей и образование других хим. связей.
Свободная энергия Гиббса ( G) – часть общей энергии системы,
которая доступна для выполнения работы.
2.Достаточная частота взаимостолкновений атомов и молекул.
3.Сталкивающиеся атомы и молекулы должны обладать повы- шенной кинетической энергией (энергия активации).
Энергетика биохимических реакций
Энергия активации (Еа) – дополнительное коли- чество кинетической энергии, которое необходимо передать молекуле, чтобы она оказалась в переход- ном состоянии и получила возможность вступать в химические реакции.
Переходное состояние обозначает максимальную способность молекулы к химическому превращению. Чем большая часть молекул в 1 моле вещества находится в переходном состоянии, тем выше V хи- мической реакции.
Энергетика биохимических реакций
Взаимодействующие молекулы должны преода- леть энергетический барьер. Именно для этого им необходимо получить дополнительное количество энергии = энергию активации (Еа).
Передать взаимодействующим молекулам допол- нительное количество кинетической энергии можно путем нагревания. Для биологических объектах нагревание свыше +40о С губительно.
В ходе эволюции сформировался механизм ускорения метаболических превращений с участием ферментов. Ферменты уменьшают величину энергии активации, при этом не повышая температуру, кото- рая способна разрушить биомолекулы.

Влияние фермента на величину энергии активации, Еа
Энергия
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ea без фермента |
|||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
S |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
E’a в присутств. |
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
ES |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
фермента |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
переходное |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
состояние |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- G |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
EP 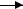







































 P
P
S+E  ES EP
ES EP  P+E
P+E
Время протекания реакции

Переходное состояние и фермент- субстратный комплекс (ES)
S(субстрат) + Е(фермент) ES EP E + P(продукт)
Время существования ES совпадает с временем продолжи- тельности переходного состояния.
Образование ES – способ уменьшения Ea, в условиях, при которых нельзя повышать Т более +37о С.
Стадия образования «первичного» ЕS комплекса протекает сравнительно быстро (завист от [S]).
Стадия превращения «первичного» ЕS комплекса в «активированный» ES комплекс – лимитирующая. На этой стадии происходит превращение S P.
Стадия диссоциации ЕР-комплекса: выход Р и освобожде- ние Е, протекает сравнительно быстро.

Зависимость V реакции от Т
Коэффициент Ван-Гоффа (Q10):
VT+10
Q10 =
VT
Коэффициент показывает: во сколько раз возрастет скорость хим. реакции при увеличении температуры на 10оС.
Для химических реакций Q10 = 2,0
Для ферментативных реакций, протекающих в организме, Q10 = 1,7

Аррениус установил зависимость между константой скорости реакции и энергией активации
dlnk Ea
=
dT RT2
График Аррениуса. С его помощью сравнительно легко опреде-
лить величину энергии активации (Еа)
Ферментативная
кинетика
E
S  P
P
В общем виде скорость (V) ферментативной реакции можно описать уравнениями:
v |
d[S ] |
v |
d[P] |
dt |
dt |
||
Если выражать через |
Если выражать через |
||
уменьшение [S] |
прирост [Р] |
||
Скорость химической реакции выражает изменение количества вещества, вступившего в реакцию (или количество вещества, образовавшегося в реакции), за единицу времени.
Одна из характеристик ферментативной реакции:
Порядок реакции
Порядок реакции определяется числом участников реакции, концентрации которых перемножаются в уравнении скорости реакции.
Реакция первого порядка:
k
А P
Если [A] обозначить a, то: v dadt ka
k – константа реакции первого порядка, размерность: с-1
V = ka = (моль * л-1) * с-1 = k * (моль * л-1), тогда: k = V / a = (моль * л-1) * с-1 / моль * л-1 = с-1
