- •АМИНОКИСЛОТЫ И БЕЛКИ
- •Белки – линейные биополимеры нерегулярной структуры, состоящие из аминокислот, соединенных пептидной связью.
- •Функции белков (найдите соответствие )
- •Классификация белков
- •Аминокислоты – азбука белка
- •Классификация аминокислот
- •Физико-химические свойства аминокислот
- •Краткое обозначение аминокислот
- •История открытия белков
- •Уровни организации белковых молекул
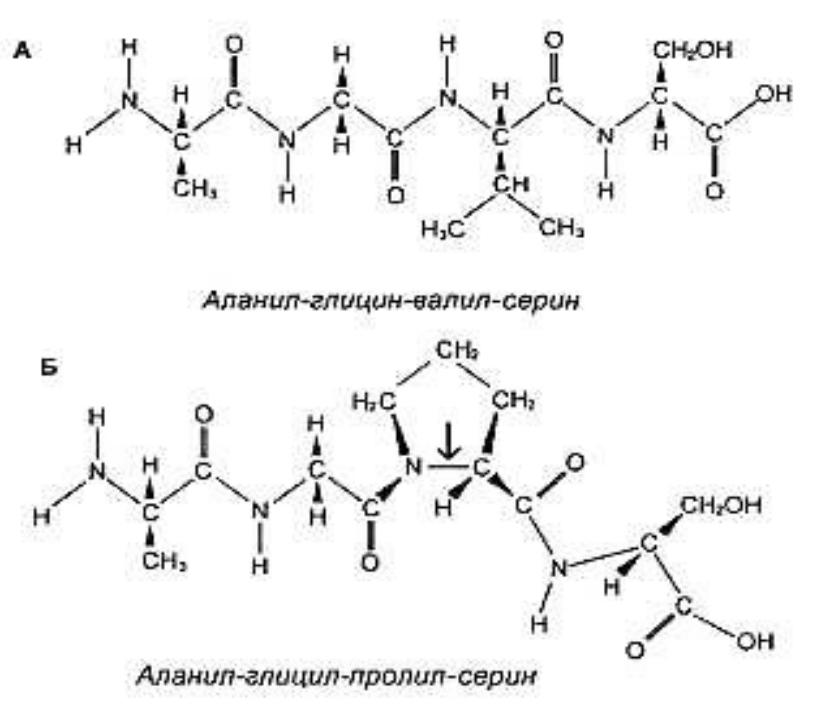
- •Первичная структура белка
- •Первичная структура белка
- •Первичная структура белка
- •L.Pouling, P.Cory (1930-е годы)
- •Опыты Anfinsen C.B.(1964 г.) демонстрируют связь первичной структуры белка, конформации и функциональной активности
- •Этапы экспериментальной расшифровки первичной структуры белка
- •Этапы экспериментальной расшифровки первичной структуры белка
- •Этапы экспериментальной расшифровки первичной структуры белка
- •Вторичная структура белка
- •Вторичная структура белка
- •Вторичная структура белка
- •Вторичная структура белка
- •Вторичная структура белка
- •Вторичная структура белка
- •Супервторичные структуры
- •Третичная структура белка
- •Третичная структура белков
- •ФОЛДИНГ
- •Шапероны
- •Четвертичная структура белка
- •Пространственная структура белка
- •Заметки о белках
- •Физико-химические свойства белков. Методы белковой химии.
- •Свойства белковых растворов
- •Свойства белковых растворов, как коллоидных систем
- •Растворимость белков
- •Какие факторы влияют на растворимость белка? Как осадить белок из раствора?
- •Центрифугирование
- •Определение молярной массы вещества с помощью ультрацентрифугирования
- •Дифференциальное
- •Другие методы белковой химии
- •Способы разделения, идентификации и определения чистоты белковых фракций
- •Способы разделения, идентификации и определения чистоты белковых фракций
- •Все способы манипуляции с белками (выделение, разделение и т.д.) - это компромисс между
- •Пептиды (условно до 5 тыс. Да)
- •Пептиды
- •Простые белки. Альбумин.
- •Сложные белки (имеют небелковые включения
- •МИОГЛОБИН и ГЕМОГЛОБИН
- •Гем- содержащие белки
- •Миоглобин
- •Гемоглобин
Вторичная структура белка
•Степень спирализации в полипептидах м.б. от 0 до 80
– 90%. Чем больше степень спирализации, тем больше форма молекулы приближается к фибриллярной.
•Факторы, препятствующие – спирализации (наличие радикалов):
•Про-, оксипро-
•Рядом стоящих одинаково- или разно-заряженных радикалов
•Асп-. cер-, тре-, лей- (если находятся рядом).
•Высокая степень спирализации в миоглобине, миозине, фибрине.
•В химотрипсине практически нет - спиральных участков.
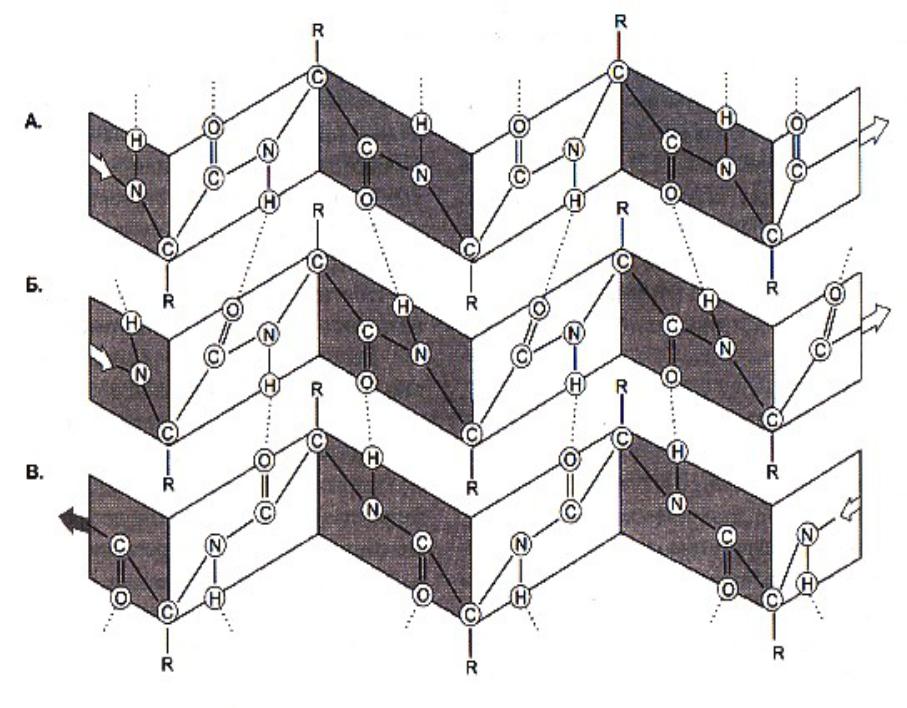
Вторичная структура белка
•В различных белках есть разные структурные мотивы (единицы скручивания):
•Радикалы глу, мет, ала, лей тяготеют к образованию –спиралей; вал,тир, изолей – к - cкладчатой структуре.
•Более того, возможны взаимные переходы- структур.(В щелочной среде, при нагревании происходит разрыв водородных связей, восстановление дисульфидных мостов, растягивание спирали: – кератин превращается в . «Гладкие» волосы становятся «волнистыми».)
Вторичная структура белка
•Коллагеновая суперспираль –
фибриллярный, нерастворимый белок соединительной ткани. Субъединицей является тропоколлаген – три полипептидных цепи, закрученных друг вокруг друга.
•В первичной структуре много глицина, пролина, оксипролина и оксилизина.
•Вытянутые спирали стабилизированы стерическим отталкиванием колец пролина и оксипролина и поперечно – расположенными водородными связями.
Вторичная структура белка
•Коллаген –сложный белок (гликопротеин), остатки глюкозы или галактозы ковалентно соединены с ОН- группами оксипролина и оксилизина.
•ОН- модификация про и лиз осуществляется Fe2+ - зависимой пролил-лизил- гидроксилазой. Восстановленная форма железа поддерживается аскорбиновой кислотой. (механизм развития цинги).

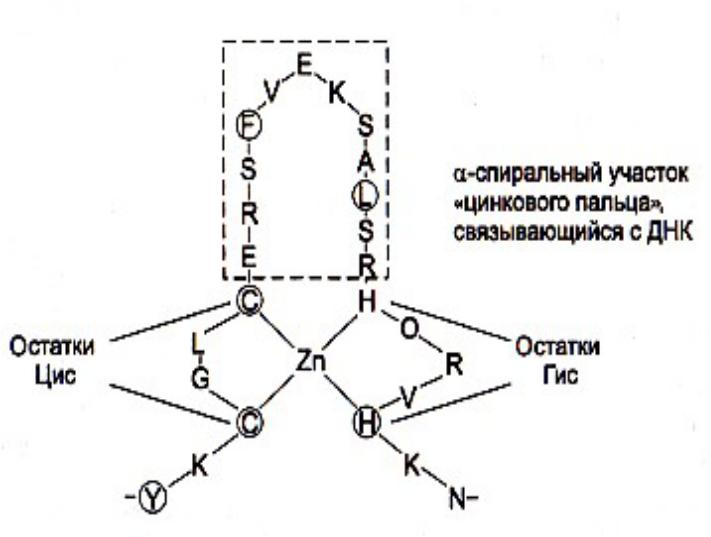
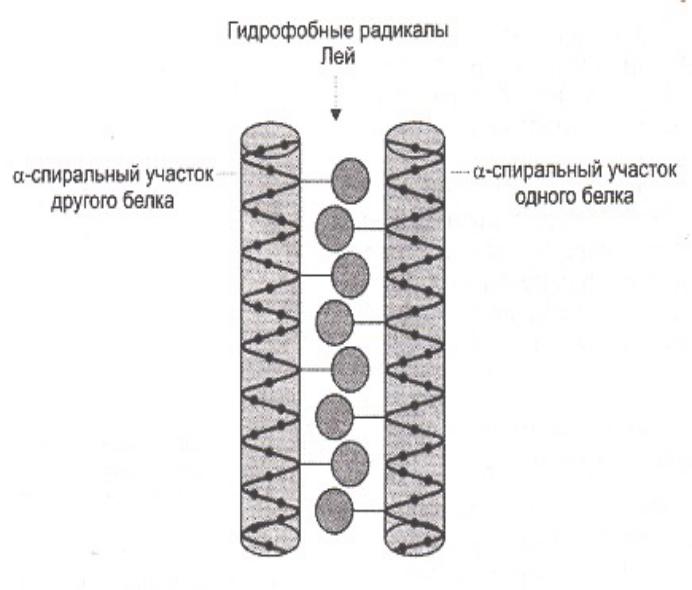
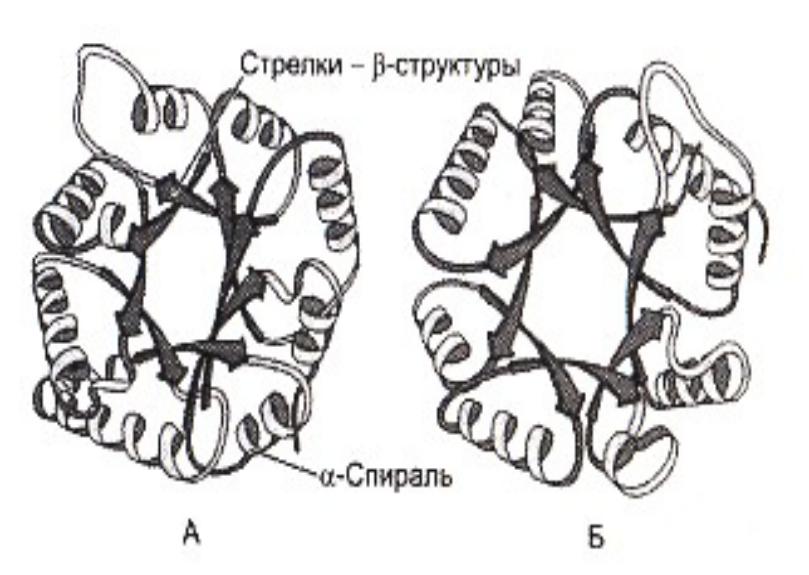
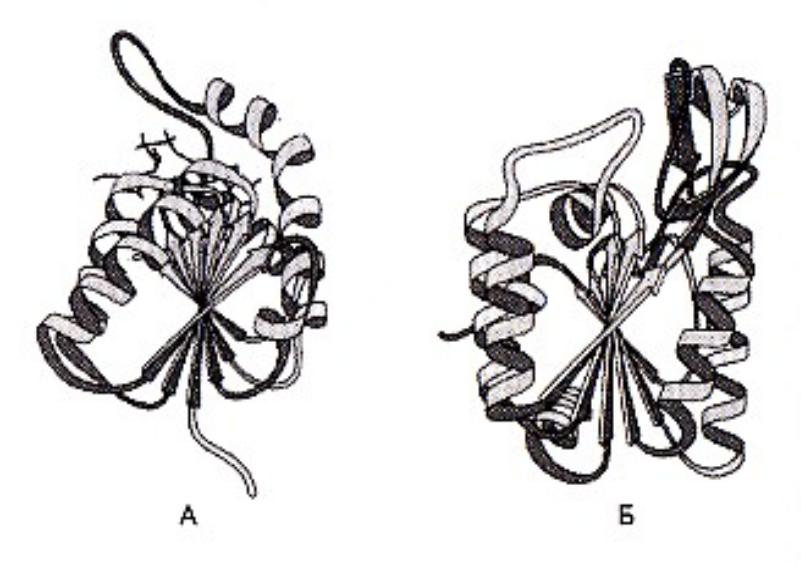
Супервторичные структуры
•Лейциновые застежки
•Цинковые пальцы
•В - бочонки