
Химия / Билет 16 Сера и ее соединения
.docБилет № 16
Сера: положение этого химического элемента в периодической системе, строение его атома. Физические и химические свойства серы. Оксиды серы, их химические свойства.
I Положение в таблице Менделеева, строение атома, возможные степени окисления.
1S22S22P63S23P43d0


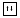






Основное состояние атома, степень окисления 0, -2, +2,
Соединения: H2S.









1-e возбужденное состояние атома, степень окисления +4,
С







 оединения:
SO2, H2SO3,
Na2SO3
оединения:
SO2, H2SO3,
Na2SO3
2-e возбуждение состояние атома, степень окисления +6
Соединения: SO3, H2SO4, Na2SO4
III Физические свойства
Аллотропные модификации – ромбическая(S8), пластическая(Sn).
Самая устойчивая сера – ромбическая. ромб.=2.07г/см3, tплав.=113оС
Желтая, хрупкая, нерастворима в воде, хорошо растворима в бензоле, анилине.
Пластическая сера – если S расплавить и тонкой струйкой влить в холодную воду, то получается резиноподобная коричневая масса. Если оставить её при комнатной to, то она перейдет в ромбическую.
IV Химические свойства
-
Окислитель
Восстановитель
H2+SH2S (150o-200oC)
2Na+S→Na2S (130oC)
Hg+S→HgS (комн. to)
Fe+S→FeS (to)
S+O2→SO2
Взаимодействие со сложными веществами
1) 3S+2H2OпарSO2+2H2S(to)
2) 3S+6NaOH→2Na2S+Na2SO3+3H2O (кипячение)
Оксид серы(IV).
I Строение молекулы
S
<120o





IV Физические свойства: бесцветный газ с резким удушливым запахом
toплавления=-75оС; toкипения=-10оС
V Действие на организм: при вдыхании SO2 происходит отек глотки и гортани из-за:
SO2+H2O→H2SO3
VI Химические свойства
SO2 – кислотный оксид
SO2+H2OH2SO3 SO2+2NaOH →Na2SO3+H2O
Na2O+SO2→Na2SO3(t) Na2CO3(p)+SO2→Na2SO3+CO2
Для сернистого газа(SO2) наиболее характерна восстановительная функция:
2SO2+O22SO3 (реакция протекает в присутствии катализатора V2O5)
S+4 - 2e-→S+6 восстановитель
O2 +4e-→2O-2 окислитель
SO3 – кислотный оксид
SO3+H2O=H2SO4
SO3+2NaOH →Na2SO4+H2O
Na2O+SO3→Na2SO4(t)
Na2CO3(p)+SO3→Na2SO4+CO2
