
Химия / Железо для 9 класса
.docЖелезо.
I Положение в таблице Менделеева – 8 группа, побочная подгруппа.
+26Fe 1S22S2SP63S23P63d64S2
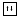









Оксиды и гидроксиды железа: FeO и Fe(OH)2 ; Fe2O3 и Fe(OH)3; смешанный оксид железа Fe3O4 или FeO∙Fe2O3
FeO основной оксид
Fe(OH)2 обладает основными свойствами.
Fe2O3 амфотерный оксид Fe(OH)3
III Физические свойства:
блестящий, серебристо-белый металл, =7.87 г/см3, to=1539оС пластичен, легко намагничивается.
V ХИМИЧЕСКИЕ СВОЙСТВА ЖЕЛЕЗА
1) взаимодействие с простыми веществами
а) с Галогенами: F2,
Cl2, Br2
2Fe + 3Cl2
![]() 2FeCl3
2FeCl3
б) c O2: 3Fe + 2O2 → Fe3O4 реакция протекает только при нагревании
в) Fe + S
![]() FeS
FeS
2) взаимодействие со сложными веществами
а) 3Fe+4H2O↔ Fe3O4+4H2 (при нагревании с парами воды)
д) Fe + H2SO4 → FeSO4 +H2 – с разбавленными кислотами
е) Fe0 + соли менее активных металлов → Fe2+
Fe + CuSO4 → FeSO4 + Cu
Оксид железа (II) FeO и соответствующий ему гидроксид железа (II) Fe(OH)2 обладают основными свойствами.
В следующей цепочке превращений показано, как из железа получить эти соединения:
Fe
![]() FeCl2
FeCl2
![]() Fe(OH)2
Fe(OH)2![]() FeO
FeO
Катионы железа 2+ легко окисляются кислородом воздуха до Fe3+, поэтому белый осадок Fe(OH)2 на воздухе сначала приобретает зеленую окраску, а затем становится бурым, постепенно превращаясь в гидроксид железа (III) Fe(OH)3
4 Fe(OH)2 +2H2O + O2 → 4Fe(OH)3
В следующей цепочке превращений показано, как из железа получить эти соединения:
Fe
![]() FeCl3
FeCl3
![]() Fe(OH)3
Fe(OH)3![]() Fe2O3
Fe2O3
Роль железа в жизнедеятельности живых организмов очень велика. Оно входит в состав гемоглобина крови, который осуществляет перенос кислорода от органов дыхания к другим органам и тканям. Соединения железа издавна применяют для лечения малокровия, при истощении, упадке сил.
