
- •Вода как химическое соединение. Классификация воды по способу взаимосвязи ее с различными веществами.
- •Химические свойства воды.
- •Водородная связь.
- •Химико-технологическая характеристика природных вод.
- •Способность воды к растворению.
- •Факторы, влияющие на формирование состава природных вод.
- •Классификация природных поверхностных вод.
- •Физические основы гидрохимических процессов.
- •Круговорот воды на Земном шаре.
- •Коллигативные свойства водных растворов.
Способность воды к растворению.
Самая удивительная способность воды – растворение.
Способность веществ к растворению зависит от их диэлектрической постоянной: чем она выше, тем больше способно вещество растворять другие вещества. Для воды эта величина больше в девять раз, чем у воздуха и вакуума, следовательно, ультрапресные и чистые воды не существуют.
В земной воде всегда что-то растворено: газы, молекулы или ионы химических веществ. В водах Мирового океана обнаружено более 80 элементов. Предполагается, что там могут быть растворены все элементы периодической таблицы.
Природные воды – растворы. Раствор – жидкая гомогенная система, состоящая из двух или более компонентов, относительные количества которой могут изменяться в значительных пределах.
Водные растворы представляют собой одну из наиболее важных представителей растворов, без которых невозможна органическая жизнь:
-
истинные (молекулярно-ионные) растворы – растворы, в которых размеры растворенных частиц меньше
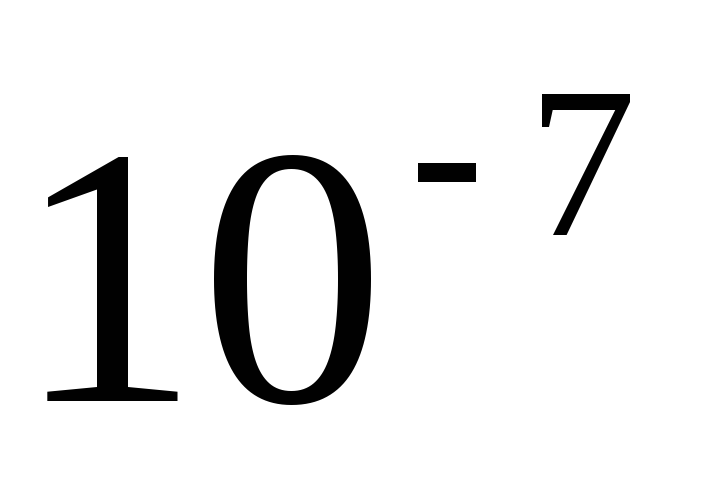 см.,
т.е. размеры самих молекул;
см.,
т.е. размеры самих молекул; -
коллоидные растворы – растворы, в которых размеры растворенных частиц находятся в интервале от
 до
до
 см.
В природе коллоидные растворы встречаются
очень часто (например, к ним относятся
растворы органических соединений в
клетках живых организмов и продукты
их распада). Существует три типа
коллоидных частиц, в соответствие с
которыми коллоидные растворы делятся
на три группы:
см.
В природе коллоидные растворы встречаются
очень часто (например, к ним относятся
растворы органических соединений в
клетках живых организмов и продукты
их распада). Существует три типа
коллоидных частиц, в соответствие с
которыми коллоидные растворы делятся
на три группы:
а). суспензоиды – коллоидные растворы металлов, окислов химических элементов, солей;
б). ассоциативные (мицеллярные) коллоидные
растворы образованы низкомолекулярными
веществами, объединенными в агрегаты
молекул (мицеллы). Например, растворы
![]() .
При этом коллоидные частицы (мицеллы)
имеют положительный заряд, хотя
большинство при рН = 6,5 – 7,5 имеют на
мицелле отрицательный заряд. Наличие
электрического заряда препятствует
коагуляции. Такая дисперсная система
может существовать неопределенно долго,
несмотря на то, что
.
При этом коллоидные частицы (мицеллы)
имеют положительный заряд, хотя
большинство при рН = 6,5 – 7,5 имеют на
мицелле отрицательный заряд. Наличие
электрического заряда препятствует
коагуляции. Такая дисперсная система
может существовать неопределенно долго,
несмотря на то, что
![]() малорастворим;
малорастворим;
в). Молекулярные коллоиды. К ним относятся растворы природных и синтетических высокомолекулярных веществ с высокой молекулярной массой от 10 тысяч до нескольких миллионов а.е.м.. Молекулы этих веществ соизмеримы с размерами коллоидных частиц и являются макромолекулами. Эти коллоиды способны превращаться в гели или студни. Высушенные студни, в отличие от гелей, способны вновь набухать в воде. Особенностью геля является способность восстанавливать структуру после прекращения механического воздействия на гель в определенных размерах, этим они отличаются от золя. Например, раствор гемоглобина – коллоидный раствор, молекулярная масса равна 64 500 а.е.м.
Если размеры частиц в растворе больше
или равны
![]() см,
то нарушается характерная особенность
раствора – его однородность, поэтому,
это уже не растворы, а механические
смеси (суспензии). При этом частицы с
размером
см,
то нарушается характерная особенность
раствора – его однородность, поэтому,
это уже не растворы, а механические
смеси (суспензии). При этом частицы с
размером
![]() см
образуют тонкие суспензии, больше
см
образуют тонкие суспензии, больше
![]() см
– грубые суспензии (взвеси). Если
агрегатное состояние такой частицы
жидкое, то образуются эмульсии.
см
– грубые суспензии (взвеси). Если
агрегатное состояние такой частицы
жидкое, то образуются эмульсии.
Растворимость твердых веществ.
При соприкосновении твердого вещества с водой ионы или молекулы, составляющие решетку, взаимодействуют с диполями воды, возникают ионно-дипольные связи. Если они окажутся прочнее кристаллизационной связи, то ионы отрываются от кристалла и переходят в раствор. Этому процессу также способствует непрерывное тепловое движение молекул.
Перешедшие в раствор ионы окружены
молекулами воды, образующиеся гидратные
оболочки ионов неустойчивы, но иногда
прочные. При кристаллизации связи
сохраняются и образуются кристаллогидраты.
Например,
![]() ,
растворяясь в воде, захватывает две
молекулы воды ионами кальция и хлора,
которые остаются в составе кристаллической
решетки этого вещества при удалении
растворителя (воды), следовательно,
образовавшийся кристаллогидрат –
,
растворяясь в воде, захватывает две
молекулы воды ионами кальция и хлора,
которые остаются в составе кристаллической
решетки этого вещества при удалении
растворителя (воды), следовательно,
образовавшийся кристаллогидрат –
![]() .
.
Существует правило образования гидратированных ионов:
-
катионам свойственна более сильная гидратация, чем анионам.
Гидратационное число катионов (число молекул воды) щелочных металлов при первичной гидратации минимум равно 4, в то время как для галоидных ионов оно меняется от 1 до 4 (максимально). В нашем примере показано на натрии минимальное гидратационное число, а на хлоре – максимальное.
-
чем больше заряд иона, тем сильнее он гидратируется (гидратационное число магния равно 6 – 12).
-
при одинаковом заряде сильнее гидратируются ионы, имеющие меньший кристаллический радиус.
Зависимость растворимости твердых веществ и жидкостей от температуры, давления и солености.
При растворении твердых тел и жидкостей
одновременно с прямым процессом
(растворение) идет обратный процесс
(кристаллизация). Чем больше площадь
соприкосновения с водой, тем больше
вещества в единицу времени раствориться
водой. Скорость растворения
![]() пропорциональна площади кристалла, а
скорость кристаллизации
пропорциональна площади кристалла, а
скорость кристаллизации
![]() определяется концентрацией уже
растворившихся ионов. Когда
определяется концентрацией уже
растворившихся ионов. Когда
![]() устанавливается динамическое равновесие,
наступает состояние насыщения. У
насыщенных растворов дальнейшее
растворение возможно только при
увеличении их температуры. При этом
усиливается тепловое движение частиц
в кристаллической решетке, силы стяжения
ослабеваются, и ионы или молекулы из
кристаллической решетки легче разрушаются
или переводятся в раствор молекулами
воды, и наоборот. Таким образом,
растворимость веществ в воде зависит
не только от природы вещества, но и от
температуры.
устанавливается динамическое равновесие,
наступает состояние насыщения. У
насыщенных растворов дальнейшее
растворение возможно только при
увеличении их температуры. При этом
усиливается тепловое движение частиц
в кристаллической решетке, силы стяжения
ослабеваются, и ионы или молекулы из
кристаллической решетки легче разрушаются
или переводятся в раствор молекулами
воды, и наоборот. Таким образом,
растворимость веществ в воде зависит
не только от природы вещества, но и от
температуры.
Влияние температуры на растворимость
зависит от изменения
![]() (энтальпии),
которым сопровождается процесс
растворения. Если растворение веществ
представляет собой эндотермический
процесс, то растворимость этих веществ
увеличивается с ростом температуры;
если процесс экзотермический –
растворимость уменьшается с ростом
температуры. Это можно объяснить с
помощью принципа Ле-Шателье:
(энтальпии),
которым сопровождается процесс
растворения. Если растворение веществ
представляет собой эндотермический
процесс, то растворимость этих веществ
увеличивается с ростом температуры;
если процесс экзотермический –
растворимость уменьшается с ростом
температуры. Это можно объяснить с
помощью принципа Ле-Шателье:
![]() (1)
(1)
На схеме (1) описан эндотермический процесс, если повысить температуру, то равновесие сместиться вправо, понизить температуру – влево.
В соответствие с кривой растворимости
на графике процесс растворения соли
![]() – экзотермический процесс.
– экзотермический процесс.
Зависимость растворимости ионно-кристаллических веществ от температуры.
Вещества с одинаковым типом межмолекулярных сил притяжения имеют тенденцию взаиморастворения, т.е. подобное растворяется в подобном.
Растворимость твердых и жидких веществ мало зависит от давления в виду слабой сжимаемости воды.
С увеличением солености (увеличения концентрации электролитов), растворимость твердых веществ растет (солевой эффект), а в случае присутствия в растворе одноименных ионов, растворимость может уменьшиться (эффект одноименного иона).
Растворимость газов в воде. Зависимость растворимости газов от их природы, температуры и солености воды.
Растворимость газов в воде уменьшается в следующем ряду (t = 20ºC):
![]() .
.
Растворимость измеряется в
![]() при общем давлении Р = 1 атм. И соответствующем
парциальном давлении.
при общем давлении Р = 1 атм. И соответствующем
парциальном давлении.
Есть газы, растворимость которых очень
велика:
![]() .
.
При растворимости газов в воде могут протекать реакции их взаимодействия с водой, поэтому растворимость газов определяется многофакторностью процессов.
Зависимость растворимости газов от давления (единичный фактор) определяется законом Генри: «Растворимость газов в данном объеме жидкости при постоянной температуре прямо пропорциональна давлению газа».
![]() , где
, где
![]() - растворимость газов в жидкости,
- растворимость газов в жидкости,
![]()
![]() - парциальное давление данного газа
над водным раствором,
- парциальное давление данного газа
над водным раствором,
![]()
![]() - коэффициент пропорциональности,
константа Генри. Этот коэффициент
выражает растворимость данного газа
при давлении Р = 1 атм. Например,
растворимость азота при t
= 25 ºC и Р = 0,78 атм. равна
- коэффициент пропорциональности,
константа Генри. Этот коэффициент
выражает растворимость данного газа
при давлении Р = 1 атм. Например,
растворимость азота при t
= 25 ºC и Р = 0,78 атм. равна
![]() ,
если удвоить давление в два раза, то
растворимость увеличится в два раза.
,
если удвоить давление в два раза, то
растворимость увеличится в два раза.
Растворимость смеси газов определяется законом Генри-Дальтона: «Растворимость каждой части смеси газов в жидкости прямо пропорциональна парциальному давлению данной составной части над другой».
![]() , где
, где
![]() - парциальное давление компонента смеси,
- парциальное давление компонента смеси,
![]()
![]() - общее давление,
- общее давление,
![]()
![]() - мольная доля данного газа в смеси.
- мольная доля данного газа в смеси.
На основании закона Генри-Дальтона
можно объяснить, почему в природных
водах, соприкасающихся с воздухом, азота
содержится больше, чем кислорода, хотя
растворимость у азота меньше. Если
содержание азота в воздухе равно 78%, а
кислорода – 21%, то соотношение
![]() , то
, то
![]() .
И растворимость этих газов при t
= 0ºC будет следующая:
.
И растворимость этих газов при t
= 0ºC будет следующая:

Что и составляет отношение растворенных
в природных водах газов
![]()
![]() парциальное
давление, которых в атмосферном воздухе
приближается к нулю, не могут в нормальных
условиях накапливаться в воде у
поверхности водоемов.
парциальное
давление, которых в атмосферном воздухе
приближается к нулю, не могут в нормальных
условиях накапливаться в воде у
поверхности водоемов.
Растворимость газов зависит также от температуры и солености воды.
В отличие от твердых веществ и жидкостей, растворимость газов с ростом температуры уменьшается. Также уменьшается растворимость газов и с ростом солености. Кроме того, фактическое содержание газов в природных водах определяется также интенсивностью химических, биологических и гидрологических (перемешивание, вертикальная зимняя циркуляция и др.) процессов, поэтому часто содержание многих газов и обязательно кислорода, азота и углекислого газа выражают в процентах от их насыщающего количества. За насыщение системы газа принимают то количество газа, которое может раствориться в воде при данной температуре и данной солености (при сухом атмосферном воздухе и нормальном давлении).
