
- •Иодометрия.
- •Определение восстановителей.
- •Определение окислителей.
- •Определение кислот.
- •Приготовление рабочих растворов.
- •Условия проведения иодометрии.
- •Лабораторная работа. Определение активного хлора в хлорной извести методом иодометрии. Определение активного хлора в белильной извести методом иодометрии.
- •Ход выполнения работы
- •Контрольные вопросы.
- •Рекомендуемая литература.
- •Лабораторная работа. Определение концентрации перекиси водорода методом иодометрии.
- •Ход выполнения работы
Лабораторная работа. Определение активного хлора в хлорной извести методом иодометрии. Определение активного хлора в белильной извести методом иодометрии.
Цель занятия– Научиться количественно определять содержание окислителей методом иодометрии.
Учебно-целевые вопросы:
Основная реакция метода.
Рабочие растворы и индикаторы.
Определение восстановителей прямым и обратным титрованием.
Определение окислителей и кислот косвенным титрованием.
Применение метода в санитарно-гигиенических исследованиях(определение иодного числа жира и кислот в пищевых продуктах).
Реактивы.
- рабочий 0,02 н раствор тиосульфата натрия
- 10% раствор иодида калия
- 4н раствор соляной кислоты
- 5% раствор крахмала
Белильная известь является одним их самых сильных окислителей, поэтому она применяется как дез. средство во всех мед. учреждениях (мытье полов, стен, посуды ит.д.).
Белильная известь представляет собой смесь хлоридов, гипохлоритов, состав которой выражается формулой CaOCl2. В кислой среде белильная известь выделяет свободный «активный хлор», который при обработке белильной извести иодидом калия окисляет иодид-ионы:
CaOCl2+2H+→ Ca2+ + Cl2 + H2O
Cl2 + 2I- →2Cl- + I2
Cуммарно оба процесса выражаются следующим уравнением:
CaOCl2 + 2H+ +2I-→ Ca2+ +I2 + H2O +2Cl-
Количество выделившегося иода эквивалентно количеству «активного хлора». Выделившийся иод затем оттитровывают тиосульфатом натрия:
I2 + 2S2O32- = 2I- + S4O62-
Затраченное количество тиосульфата натрия косвенно эквивалентно количеству «активного хлора».
n(Cl2) = n(I2) = n(Na2S2O3)
Ход выполнения работы
Полученную навеску белильной извести растереть в фарфоровой ступке с несколькими каплями воды и небольшими порциями сливать с дистиллированной водой в мерную колбу емкостью 100 мл, довести объем водой до метки и перемешать.
В колбу для титрования пипеткой вносят 10 мл полученной суспензии, прибавляют туда же мерным цилиндром по 10 мл иодида калия и соляной кислоты. Содержимое в колбе окрашивается в цвет иода, что указывает на его образование.
Образовавшийся иод титруют титрованным раствором тиосульфата натрия до соломенного цвета, затем вносят индикатор (2-3 капли 5% свежеприготовленного раствора крахмала) и продолжают титровать до исчезновения синей окраски. Повторить титрование 3 раза, результаты занести в журнал.
По среднему объему тиосульфата рассчитать массу хлора -m(Cl2) в навеске двумя способами:
а) через титр тиосульфата (![]() );
);
б) через титр тиосульфата натрия по
хлору (![]() );
);
5. Рассчитать процентное содержание хлора в навеске.
6. Оформить отчет по лаб. работе. Определить метод и вид титрования. Написать все уравнения реакций в молекулярном виде, составить для каждой ионно-электронный баланс, определить эквивалентные массы окислителей и восстановителей в данных реакциях..
Контрольные вопросы.
Какие реакции называются окислительно-восстановительными?
От чего зависит скорость окислительно-восстановительных реакций?
Какие рабочие растворы и индикаторы используются в иодометрии?
Чему равна эквивалентная масса тиосульфата в реакции с иодом?
Как определяются окислители, восстановители, кислоты данным методом?
К навеске 1,5 г технического сульфита натрия после растворения было прибавлено 100 мл 0.1 н раствора иода. На титрование избытка иода потребовалось 42 мл 0,05н раствора Na2S2O3∙5Н2О. Определить содержаниеNa2SO3 в техническом образце.
К 30 мл 0,105н KMnO4 прибавили избытокKI, и Н2SO4. На титрование выделившегося иода израсходовали 33 мл тиосульфата натрия. Определить
 .
.Какая масса K2Sсодержится в растворе, если на титрование этого раствора расходуется 40 мл 0,02н раствора иода?
Сколько мл 0,5н раствора Na2S2O3потребуется для титрования иода, выделившегося при взаимодействии 50 мл 0,2н раствораKMnO4с избыткомKI, и Н2SO4?
Сколько потребуется тиосульфата натрия для приготовления 0,5 л 0,02н раствора?
К 30 мл 0,107н раствора HClприбавлен избытокKIиKIO3.На титрование выделившегося иода было затрачено 33,27 мл тиосульфата натрия.Определить
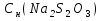 .
.Определить фактор эквивалентности для I-при окислении доI2.
Какие вещества анализируют в методе иодометрии обратным титрованием?
Почему при иодометрическом определении окислителей и кислот иодид калия добавляют в избытке?
В реакциях осаждения эквивалентная концентрация раствора K2Cr2O7составляет 0,1 моль/л. Вычислить эквивалентную концентрацию этого раствора в реакциях окисления.
