
1
.docxДля таких систем имеется второй закон Коновалова: если давление и T сосуществования 2-х бинарных фаз имеют экстремум (max или min), то составы фаз одинаковы.
При изменении внешних условий – температуры или давления значение α изменяется различно по разные стороны от точки азеотропа: одна часть «рыбка»
(б, в) должна становиться шире, другая уже.
Смещение состава азеотропов при изменении внешних условий определяется вторым законом Вревского: если давление (или T) системы жидкость – пар имеет максимум, то при повышении T в азеотропной смеси возрастает концентрация того компонента, парциальная молярная теплота испарения которого больше, а если давление (или T) система жидкость – пар имеет минимум, то при повышении T в азеотропной смеси возрастает концентрация компонента с меньшей теплотой испарения.
Этот закон определяет возможности разделения азеотропных смесей изменением давления при перегонке. При этом точка азеотропы перемещается на диаграмме y-x и в принципе может совпасть, например, с правым верхним углом диаграммы. Тогда азеотропную смесь можно разделить перегонкой.
Таким образом, законы Коновалова характеризуют изменение состояния равновесия 2-х фазных систем при изобарных или изотермических условиях, а законы Вревского определяют закономерности влияния на фазовое равновесие бинарных систем изменений температуры и давления.
Частично взаиморастворимые жидкости.
Взаимная растворимость существенно зависит от состава и температуры. Обычно растворимость жидкостей с ростом температуры T°С растет. Типичная кривая растворимости двух частично растворимых жидкостей приведена на рис. 3.4.
Рис. 3.4. Типичная кривая растворимости двух частично растворимых жидкостей.
Если
задана температура
 ,
то в области концентраций
,
то в области концентраций
 и
и
 возникает гомогенная система при полной
растворимости жидкостей. При этом
системы могут подчиняться закону Рауля.
В интервале от
возникает гомогенная система при полной
растворимости жидкостей. При этом
системы могут подчиняться закону Рауля.
В интервале от
 до
до
 образуются 2 нерастворимые друг в друге
жидкости с концентрацией
образуются 2 нерастворимые друг в друге
жидкости с концентрацией
 в
одной жидкой фазе и
в
одной жидкой фазе и
 – в другой. Изменяются их количества,
но остаются постоянными составы жидких
фаз. В равновесии с жидкостями находится
паровая фаза определенного состава.
При
– в другой. Изменяются их количества,
но остаются постоянными составы жидких
фаз. В равновесии с жидкостями находится
паровая фаза определенного состава.
При
 образуется гомогенный раствор при
смешении жидкостей в любых соотношениях.
В этом случае концентрация паровой фазы
будет зависеть от состава жидкой фазы.
образуется гомогенный раствор при
смешении жидкостей в любых соотношениях.
В этом случае концентрация паровой фазы
будет зависеть от состава жидкой фазы.
Как
видно из рис.3.5, что в пределах концентраций
 и
и
 параметры Р и y
не меняются, т.е. не зависят от x.
Пример – фенол в воде. Такие жидкости
наиболее часто разделяются экстракцией.
параметры Р и y
не меняются, т.е. не зависят от x.
Пример – фенол в воде. Такие жидкости
наиболее часто разделяются экстракцией.

Рис.3.5 Диаграммы P – x и y – x для смесей жидкостей,
ограниченно растворимых друг в друге
Практически взаимонерастворимые жидкости.
Такие системы образуют два слоя и могут быть разделены путем отстаивания.
Система, состоящая из двух 9нерастворимых компонентов и 3-х фаз (2-х жидких и одной паровой) имеет согласно правилу фаз, одну степень свободы. Отсюда следует, что каждой T смеси отвечает строго определенное давление, и каждый компонент смеси ведет себя независимо от друга Соответственно, парциальное давление каждого компонента не зав-т от его содержания в смеси и равно давлению паров чистого компонента при той же температуре.

Рис.3.6. Фазовые диаграммы смесей взаимонерастворимых жидкостей.
Как видно из диаграммы p-x:
 ,
,
 (3.9)
(3.9)
В
диаграмме T-x,y:
 - температура кипения чистого компонента
А,
- температура кипения чистого компонента
А,
 - температура кипения чистого компонента
В,
- температура кипения чистого компонента
В,
 - температура кипения смеси.
- температура кипения смеси.
 -
температура кипения смеси (А+В), как
видно из рис.3.6 не зависти от состава
смеси (АВ-горизонтальная линия).
Характерно, что температура кипения
смеси
-
температура кипения смеси (А+В), как
видно из рис.3.6 не зависти от состава
смеси (АВ-горизонтальная линия).
Характерно, что температура кипения
смеси
 всегда ниже температуры кипения чистых
компонентов, составляющих смесь.
всегда ниже температуры кипения чистых
компонентов, составляющих смесь.
Для взаимно нерастворимых жидкостей состав пара над кипящей смесью постоянен и не зависит от соотношения компонентов в растворе.
По закону Дальтона имеем:
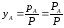 ,
,

 (3.10)
(3.10)
Соотношение
между количествами
 и
и
 компонентов в парах следующее:
компонентов в парах следующее:
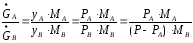 (3.11)
(3.11)
где МА, MВ - молекулярные веса компонентов A и В.
Примеры: ввода – бензол, вода – органические жидкости.
36. Простая перегонка(дистилляция).
По способу разделения паровой и жидкой фаз дистилляцию подразделяют на однократную, многократную и постепенную.
При однократной дистилляции все количество образовавшихся при частичном испарении исходной жидкой смеси жидкого остатка и равновесного с ним пара отделяется друг от друга однократно. В случае многократной дистилляции процесс однократной дистилляции применяется многократно по отношению к жидкому остатку. То есть в начале происходит процесс отделения равновесного пара от жидкого остатка, а затем этот остаток вновь частично испаряется с последующим определением от него образовавшегося пара и т.д. При постепенной дистилляции пары определяются от жидкого остатка по мере их образования. Таким образом постепенную дистилляцию можно рассматривать как предельный случай многократной.
Однократная дистилляция.
Однократную
дистилляцию можно проводить как
непрерывно, как и периодически. На рис.
3.7 представлена схема непрерывной
однократной дистилляции, где

 и
и
 - мольные расходы исходного раствора,
кубового остатка и дистиллята
соответственно;
- мольные расходы исходного раствора,
кубового остатка и дистиллята
соответственно;
 и
и
 - составы исходного раствора, кубового
остатка и дистиллята соответственно.
- составы исходного раствора, кубового
остатка и дистиллята соответственно.
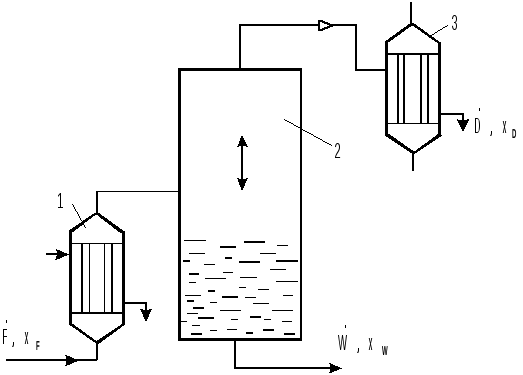
Рис. 3.7. Схема установки для непрерывной однократной дистилляции: 1 - испаритель; 2 - сепаратор; 3 - конденсатор.
На ри.3.8 представлена схема многократной дистилляции на примере двухкратной. В этом случае кубовый остаток, полученный при однократной дистилляции вновь подвергается ей повторно. Поскольку после каждой

Рис. 3.8. Схема установки непрерывной двукратной дистилляции: 1 - испарители; 2 - сепараторы; 3 - конденсаторы.
ступени
в жидкой смеси, подвергаемой дистилляции,
доля легколетучего компонента будет
уменьшаться, то уменьшаться его доля
будет в кубовом остатке и в дистилляте:

 .
.
Постепенная дистилляция.
Обычно
процесс постепенной дистилляции проводят
периодически (рис.3.9). При периодической
перегонке жидкость постепенно испаряется,
образующиеся пары удаляются и
конденсируются, получают дистиллят.
При этом содержание НК в исходной
жидкости постепенно уменьшается, что
приводит к снижению содержания НК в
дистилляте В начале процесса перегонки
содержание НК в дистилляте максимально,
в конце минимально. Процесс заканчивается
по истечении времени
 при достижении заданного состава
кубового остатка
при достижении заданного состава
кубового остатка
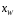 или среднего состава дистиллята
или среднего состава дистиллята
 .
Следить за изменением состава кубового
остатка
.
Следить за изменением состава кубового
остатка
 можно по его температуре (рис.3.10).
можно по его температуре (рис.3.10).

Рис. 3.9. Схема установки постепенной дистилляции: 1 - куб-испаритель; 2 - конденсатор; 3 - сборник дистиллята; 4 - измеритель
температуры.

Рис. 3.10. Изменение составов куба и дистиллята, а также температуры процесса постепенной дистилляции со временем.
Для
повышения степени разделения смеси
применяют дефлегматор. Дефлегмация –
частичная конденсация паров с возвратом
конденсата в куб с целью обогащения
оставшегося пара НК. Пары из перегонного
куба поступают в дефлегматор, где они
частично конденсируются, в основном ВК
и получаемая жидкость (флегма) сливается
в куб. Пары обогащенные НК, направляются
в конденсатор-холодильник, где полностью
конденсируются. Окончание операции
контролируют по
 смеси
в кубе, которая должна соответствовать
заданному состава остатка.
смеси
в кубе, которая должна соответствовать
заданному состава остатка.

Рис.3.11. Схема установки постепенной фракционной дистилляции: 1 - куб-испаритель, 2 - конденсатор; 3 - сборники дистиллята; 4 - измеритель температуры.
Материальный баланс постепенной дистилляции.
В
данный момент количество жидкости L,
а ее состав х (по НК) и
 в паре над жидкостью. Количество НК в
жидкости Lx.
За время dt
испарится dL
смеси, концентрация НК уменьшится на
dx:
в паре над жидкостью. Количество НК в
жидкости Lx.
За время dt
испарится dL
смеси, концентрация НК уменьшится на
dx:
Lx=(L-dL)(x-dx)+y*dL (3.12)
Раскрывая скобки и пренебрегая членом dLdx, как величину второго порядка, после разделения переменных получим:


 (3.13)
(3.13)
Здесь
 - количество исходной смеси;
- количество исходной смеси;
 -
количество кубового остатка;
-
количество кубового остатка;
 и
и
 -
концентрация НК в исходной смеси и в
остатке соответственно.
-
концентрация НК в исходной смеси и в
остатке соответственно.
Вид
функции y*=f(x)
определяется формой кривой равновесия,
которая является специфической для
каждой системы жидкость – пар. Поэтому
уравнение (3.13) решается графически,
построением зависимости
 от х (рис.3.12).
от х (рис.3.12).

Рис.3.12. К расчету материального баланса постепенной дистилляции.
Зная
 по уравнению (3.13), по площади под кривой
на графике находим W.
Количество дистиллята определяется
D=
по уравнению (3.13), по площади под кривой
на графике находим W.
Количество дистиллята определяется
D= .
Составим материальный баланс по НК:
.
Составим материальный баланс по НК:
 (3.14)
(3.14)
Здесь
-
 -
средний состав получаемого дистиллята.
-
средний состав получаемого дистиллята.
Находим
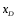 :
:
 (3.15)
(3.15)
Итак, нашли количество и средний состав дистиллята.
37.Ректификация.
Ректификация - процесс разделения жидких смесей, который сводится к одновременно протекающей и многократно повторяемых процессов частичного испарения и конденсации разделяемый смеси на поверхности контакта фаз.
Рассмотрим непрерывную бинарную ректификацию (рис.3.13).

Рис. 3.13. Схема установки непрерывной ректификации: 1 - ректификационная колонна; 2 - дефлегматор; 3 - холодильник дистиллята; 4 - холодильник кубового остатка; 5 - кипятильник кубового остатка; 6 - подогреватель исходной смеси; 7 - делитель флегмы; 8 - делитель кубового остатка; 9 - сборник кубового остатка; 10 - сборник дистиллята.
Рассмотрим
работу ректификационной установки на
примере тарельчатой колонны (принципиальных
отличий в работе колонн других конструкций
нет). Исходная смесь состава
 с расходом
с расходом
 поступает в подогреватель 6, где
нагревается до температуры, как правило,
близкой к температуре кипения и подается
в колонну 1. Обычно исходная смесь
подается в колонну в жидком состоянии,
но иногда может подаваться в виде пара
или смеси пара и жидкости. Тарелка, на
которую поступает исходная смесь,
называется питательной
или тарелкой
питания. Она
делит колонну на две части: верхнюю,
называемую укрепляющей,
и нижнюю - исчерпывающую.
Жидкость стекает с каждой тарелки на
более нижнюю, контактируя с восходящим
неравновесным потоком пара. При этом
из пара в жидкость переходит ВК, а из
жидкости в пар - НК. Таким образом,
жидкость, стекая вниз, обогащается ВК
и из нижней части колонны отводится
кубовый остаток, в котором преобладает
ВК по сравнению с исходной смесью
поступает в подогреватель 6, где
нагревается до температуры, как правило,
близкой к температуре кипения и подается
в колонну 1. Обычно исходная смесь
подается в колонну в жидком состоянии,
но иногда может подаваться в виде пара
или смеси пара и жидкости. Тарелка, на
которую поступает исходная смесь,
называется питательной
или тарелкой
питания. Она
делит колонну на две части: верхнюю,
называемую укрепляющей,
и нижнюю - исчерпывающую.
Жидкость стекает с каждой тарелки на
более нижнюю, контактируя с восходящим
неравновесным потоком пара. При этом
из пара в жидкость переходит ВК, а из
жидкости в пар - НК. Таким образом,
жидкость, стекая вниз, обогащается ВК
и из нижней части колонны отводится
кубовый остаток, в котором преобладает
ВК по сравнению с исходной смесью
 .
Часть кубового остатка, разделяясь в
делителе 8, отводится в виде конечного
продукта в сборник 9, а другая - поступает
в кипятильник 5, испаряется и подается
в виде пара в колонну под нижнюю тарелку.
.
Часть кубового остатка, разделяясь в
делителе 8, отводится в виде конечного
продукта в сборник 9, а другая - поступает
в кипятильник 5, испаряется и подается
в виде пара в колонну под нижнюю тарелку.
Пар
проходит через тарелки, контактируя с
жидкостью, обогащается НК и отводится
из верхней части колонны в дефлегматор
2, где, как правило, полностью конденсируется.
Конденсат разделяется в делителе 7 на
две части, одна из которых отводится в
виде дистиллята в сборник готового
продукта 10. Содержание НК в нем выше,
чем в исходной смеси
 .
Другая часть конденсата, называемая
флегмой, подается на верхнюю тарелку и
стекает вниз для обеспечения контакта
с паром в верхней части колонны. Если в
дефлегматоре весь пар конденсируется
то составы пара
.
Другая часть конденсата, называемая
флегмой, подается на верхнюю тарелку и
стекает вниз для обеспечения контакта
с паром в верхней части колонны. Если в
дефлегматоре весь пар конденсируется
то составы пара
 ,
дистиллята
,
дистиллята
 и флегмы
и флегмы
 одинаковы
одинаковы
 и в делителе 7 происходит лишь разделение
жидкого потока на части без изменения
его состава.
и в делителе 7 происходит лишь разделение
жидкого потока на части без изменения
его состава.
При взаимодействии поднимающихся паров со стекающей жидкостью происходит частичная конденсация паров и частичное испарение жидкости (флегмы) за счет теплоты конденсации. При этом из пара конденсируется в основном ВК, а из флегмы, в основном, НК. Таким образом отекающая флегма непрерывно обогащаются ВК, а поднимающиеся пары – НК.
Если
вся жидкость, поступающая в кипятильник
5, испаряется, то состав пара, поступающего
в колонну
 равен составу кубового остатка
равен составу кубового остатка
 .
.
Исходная
смесь состава x1
нагрета до Т1
кипения
(рис.3.14). При этом получим пар, находящийся
в равновесии с жидкостью. При конденсации
этого пара образуется жидкость (конденсат)
состава х2
=y1*,
которая обогащена НК. Нагрев эту жидкость
до Т2,
и сконденсировав образующие пары,
получим конденсат состава х3=y2*.
Как видно
 .Таким
образом можно получить жидкость,
практически из НК. Поскольку жидкость
бинарная, кубовый остаток получил в
виде почти чистого ВК.
.Таким
образом можно получить жидкость,
практически из НК. Поскольку жидкость
бинарная, кубовый остаток получил в
виде почти чистого ВК.

Рис.3.14. Фазовая диаграмма Т – x,y при Р=const.
Процесс ректификации осуществляется периодически или непрерывно, при ратм, рвак и ризб.
Для непрерывного процесса ректификации необходимо, чтобы исходная смесь соприкасалась со встречным потоком пара с несколько большей концентрацией ВК, чем в жидкой смеси. Положение питающей тарелки рассчитывают с учетом этого обстоятельства.
Для удобства анализа и расчета процесса ректификации вводят понятие о флегмовом числе R. Отношение киломолей флегмы Ф, приходящейся на 1 кмоль отбираемого дистиллята D, называют флегмовым числом:
R=Ф/D (3.16)
Материальный баланс непрерывной ректификации бинарных смесей.
Известно два основных метода анализа работы и расчета ректификационных колонн: графоаналитический (проще графический) и аналитический. Рассмотрим более простой и наглядный графический метод.
Введем основные допущения:
молярные теплоты испарения или конденсации компонентов при одной и той же температуре приблизительно одинаковы. Отсюда следует, что при конденсации 1кмоль ВК в колонне испаряется 1кмоль НК, т.е. количество паров (в кмолях), поднимающихся по колонне постоянно;
дефлегматоре
не происходит изменение состава пара.
Если пар полностью конденсируется в
дефлегматоре, то
 .
.
при испарении жидкости в кипятильнике не происходит изменения ее состава. Следовательно, состав пара, образующегося в кипятильнике, соответствует составу кубового остатка: yW=xW;
теплоты смешения компонентов разделяемой смеси равны нулю.
Кроме того, смесь, подлежащая разделению, поступает в колонну нагретая до температуры кипения на питающей тарелке. Эти допущения мало искажают реальный процесс, но существенно упрощают расчет.
Материальный баланс колонны по всему потоку:
 (3.17)
(3.17)
но
 ,
поэтому
,
поэтому
 (3.18)
(3.18)
Материальный баланс по НК:
 (3.19)
(3.19)
Уравнения рабочих линий.
Поскольку условия работы укрепляющей и исчерпывающей частей ректификационной колоны различны, поэтому материальный баланс для них рассмотрим отдельно (рис.3.15).

Рис. 3.15. Схема материального баланса ректификационной колонны: а – укрепляющая часть, б – исчерпывающая часть.
Укрепляющая часть. Составим материальный баланс по НК для верха этой части колонны:
 (3.20)
(3.20)
Количество поднимающихся паров по колонне:

По (3.20) находим y:
 (3.21)
(3.21)
По
условию yD=xD,
и меняя
 получим:
получим:
 (3.22)
(3.22)
Окончательно:
 (3.23)
(3.23)
Это и есть уравнение рабочей линии укрепляющей части колонны, которая является уравнением прямой линии. Это уравнение справедливо до сечения ввода исходной смеси, т.е. до точки b, соответствующий концентрации xF.
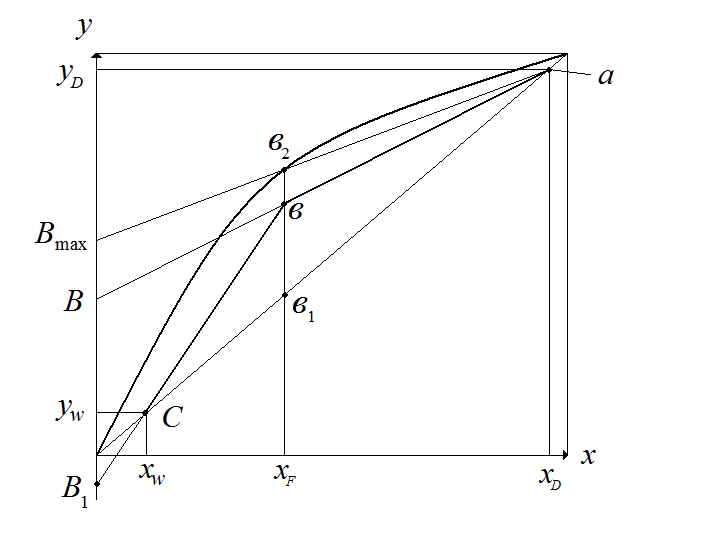
Рис.3.16. Рабочие линии и линия равновесия ректификационной колонны.
Исчерпывающая часть. Рассмотрим материальный баланс для низа исчерпывающей части колонны - ниже произвольного сечения В-В, где текущие концентрации НК в фазах x и y (рис. 5.38):
 (3.24)
(3.24)
Здесь
 ,
,
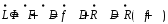 ,
,
 ,
f>1
,
f>1
Находим y (yW=xW):
 (3.25)
(3.25)
При х=хW, у=уW=xW, т.е. рабочая линия исчерпывающей части колонны проходит через точку, лежащей на диагонали с абсциссой хW.
Положение
точек
 и c
определены, они лежат на диагонали.
Точка в
пересечении линий
и c
определены, они лежат на диагонали.
Точка в
пересечении линий
 и сВ1.
Положение точки b
соответствует
xF,
т.е. соответствует сечению, на уровне
которого подают питание в колонну.
и сВ1.
Положение точки b
соответствует
xF,
т.е. соответствует сечению, на уровне
которого подают питание в колонну.
Для
определения числа теоретических ступеней
изменения концентрации между рабочей
и равновесной линиями строят ступень
в интервале концентраций
 .
При ректификации рабочие линии
располагаются ниже линии равновесия.
.
При ректификации рабочие линии
располагаются ниже линии равновесия.
Выбор флегмовога числа.
Практически
R
не бывает задано, и его нужно правильно
выбрать. Точка пересечения рабочих
линий
 зависит от величины
зависит от величины
 ,
которая однозначно меняется с изменением
R,
так как
,
которая однозначно меняется с изменением
R,
так как
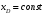 .
Для точки
.
Для точки

 и
и
 и движущая сила процесса равно нулю.
Для точки
и движущая сила процесса равно нулю.
Для точки
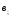
 ,
,
 и движущая сила максимальная. Минимальное
значение флегмового числа определяется
для точки
и движущая сила максимальная. Минимальное
значение флегмового числа определяется
для точки
 по формуле:
по формуле:
 (3.26)
(3.26)
На
практике применяют

От R зависит размеры аппарата и расход теплоносителей. Следовательно капитальные и эксплуатационные затраты. Эксплуатационные затраты (расход теплоносителей) возрастают прямо пропорционально R. С увеличением R возрастает движущая сила процесса и уменьшается необходимое число теоретических ступеней. При некотором R рабочий объем колонны станет минимальным, минимальным будет стоимость колонны. Найти Rопт достаточно сложно, поэтому выбор действительного R производят приближенно.
38. Тепловой баланс ректификационной колонны.
Составим тепловой баланс колонны непрерывного действия, изображенной на рис. 3.17.

Рис. 3.17. Схема теплового баланса ректификационной колонны.
 (3.24)
(3.24)
 приход
теплоты с теплоносителем в кипятильнике,
приход
теплоты с теплоносителем в кипятильнике,
 расход теплоты с
уходящим из колонны паром,
расход теплоты с
уходящим из колонны паром,
 приход
теплоты с исходной смесью,
приход
теплоты с исходной смесью,
 расход
теплоты с уходящим из колонны кубовым
остатком,
расход
теплоты с уходящим из колонны кубовым
остатком,
 приход
теплоты флегмой
приход
теплоты флегмой
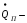 потери
тепла в окружающую среду.
потери
тепла в окружающую среду.
C учетом того, что

 ,
имеем
,
имеем
 (3.25)
(3.25)
Решив
(3.25) относительно
 получим :
получим :
 (3.26)
(3.26)
Здесь:
 -
теплота испарения флегмы,
-
теплота испарения флегмы,
 - теплота на
испарение дистиллята,
- теплота на
испарение дистиллята,
 - теплота на обогрев
кубового остатка от температуры исходной
смеси, до температуры остатка.
- теплота на обогрев
кубового остатка от температуры исходной
смеси, до температуры остатка.
Расход греющего пара в кипятильнике определяется по формуле:
 ,
(3.27)
,
(3.27)
где r- теплота парообразования греющего пара.
Потери тепла в окружающую среду при наличии тепловой изоляции, обычно, невелики и составляют 3-5% от полезной нагрузки кипятильника.
Расход теплоты на ректификацию велик. Поэтому необходимо предусмотреть рекуперацию части тепла.
39. Периодическая ректификация
Ректификационные установки периодического действия используются преимущественно в малотоннажных производствах.
Исходную смесь загружают в куб и подогревают до кипения. Образующиеся в кубе пар, поднимаясь по колонне, обогащается НК в результате контакта со стекающей вниз флегмой, которая по мере движения к кубу обогащается ВК. Пары из колонны отводится в дефлегматор, где они конденсируются (полностью или частично). Жидкость в кубе постепенно обогащается ВК, теряя НК, который уносится паром. После достижения заданного состава кубовый жидкости, что можно установить по температуре кипения, ее сливают, а в куб загружают новую порцию исходной смеси (рис.3.18)
Таким образом, колонна работает в режиме укрепляющей части, роль исчерпывающей части играет куб.

Рис.3.18. Схема установки периодической ректификации:
1 – куб – испаритель, 2 – ректификационная колонна, 3 – дефлегматор, 4 – делитель флегмы, 5 – холодильник дистиллята, 6 – сборник дистиллята, 7 – холодильник кубового остатка, 8 – сборник кубового остатка.
Периодическую ректификацию можно провести двумя способами:
при постоянном флегмовом числе (R=const)
при
постоянном составе дистиллята ( =const)
=const)
Случай
R=const.
Поскольку ввод питания в колонну
отсутствует ,то расходы жидкости и пара
по высоте колонны не изменяются, что
обуславливает единственную рабочую
линию, соответствующую рабочей линии
верхней части колонны непрерывного
действия. Отличие будет заключаться в
уменьшении состава дистиллята с течением
времени
 ,
что приводит к параллельному переносу
рабочей линии вниз для каждого последующего
момента времени (рис.3.19 и рис.3.20) .
,
что приводит к параллельному переносу
рабочей линии вниз для каждого последующего
момента времени (рис.3.19 и рис.3.20) .

