
1
.docxПри выражении состава фаз не в абсолютных, а в относительных концентрациях видоизменяется и запись закона Генри.
Общая масса фазы, состоящей из распределяемого компонента и 1 кг носителя равна (1+Х) кг (жидкая фаза) и (1+У) кг (газовая фаза). Тогда весовые концентрации х и у распределяемого компонента в фазах:


Тогда закон Генри запишется:
 (2.6)
(2.6)
Следовательно, линия равновесия в системе газ – жидкость в координатах Х и У изображается кривой. При малых концентрациях Х в жидкости (2.6) упрощается и принимает вид:

В случае абсорбции многокомпонентных смесей парциальное давление каждого компонента в газовой смеси зависит не только от его концентрации в растворе, но и от концентрации в растворе других компонентов, т.е. является функцией большого числа переменных. Поэтому в подобных случаях, равновесные зависимости основываются на опытных данных.
33. Материальный баланс и расход абсорбента
Сначала рассмотрим противоточную абсорбцию. Материальный баланс запишем в виде:

Рис.2.2 Противоточная абсорбция.
 (2.7)
(2.7)
 – расход инертного
газа (кмоль/с);
– расход инертного
газа (кмоль/с);
 – расход абсорбента (кмоль/с);
– расход абсорбента (кмоль/с);
 -
начальная и конечная концентрация
абсорбтива в газовой смеси, кмоль/кмоль
инертного газа;
-
начальная и конечная концентрация
абсорбтива в газовой смеси, кмоль/кмоль
инертного газа;
 -
начальная и конечная концентрация
абсорбтива в в поглотителе кмоль/кмоль
абсорбента.
-
начальная и конечная концентрация
абсорбтива в в поглотителе кмоль/кмоль
абсорбента.
Из
уравнения (2.7) обычно определяют
 :
:
 (2.8)
(2.8)
Уравнение (2.7) можно представить в виде:
 (2.9)
(2.9)
где
 -
удельный расход абсорбента.
-
удельный расход абсорбента.
Уравнение
(2.9) носит название рабочей линии. Она,
рабочая линия, в координатах У-Х прямая
с углом наклона, тангенс которого равен
 .
Найдём связь
.
Найдём связь
 с размером аппарата. Заданы
с размером аппарата. Заданы
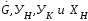 .
Необходимо найти
.
Необходимо найти
 .
.
Рис.2.3.
Определение удельного расхода абсорбера
 .
.
Поскольку
 известно, точки
известно, точки
 лежат на одной прямой линии
лежат на одной прямой линии и
и
 граничные случаи. При АВ движущая сила
максимальна
граничные случаи. При АВ движущая сила
максимальна
 поскольку
поскольку
 (см. уравнение (2.8)). При
(см. уравнение (2.8)). При
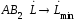 ,
движущая сила минимальна: в точке
,
движущая сила минимальна: в точке
 она равна нулю. Поэтому
она равна нулю. Поэтому
 должна быть больше
должна быть больше
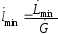 .
.
 (2.10)
(2.10)
Для
предварительных расчетов, можно принять
 .
Тогда по (2.9) находим
.
Тогда по (2.9) находим
 .
Итак определены искомые величины для
противоточного аппарата.
.
Итак определены искомые величины для
противоточного аппарата.
Уравнения
материального баланса для прямотока
аналогичны уравнениям материального
баланса противотока (2.7) – (2.9). Однако
 для прямотока гораздо меньше аналогичного
параметра для противотока (рис.2.4). Итак
имеем:
для прямотока гораздо меньше аналогичного
параметра для противотока (рис.2.4). Итак
имеем:


 (2.11)
(2.11)
Согласно уравнению (2.10) получим:



Удельный
расход абсорбента
 при противотоке меньше, чем при прямотоке.
при противотоке меньше, чем при прямотоке.

Рис.2.4.Прямоточная абсорбция.
Эффективность
работы массообменного аппарата может
быть охарактеризована степенью извлечения
распределяемого компонента из отдающей
его фазы. Коэффициент извлечения
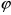 определяется как отношение количества
компонента перешедшую в другую фазу к
максимально возможному:
определяется как отношение количества
компонента перешедшую в другую фазу к
максимально возможному:
 (2.13)
(2.13)
Для
одинаковых
 и
и
 при противотоке
при противотоке
 больше, чем при прямотоке. Этим объясняется
преимущественное применение противоточного
движения фаз в процессе абсорбции.
больше, чем при прямотоке. Этим объясняется
преимущественное применение противоточного
движения фаз в процессе абсорбции.
33.Тепловой баланс абсорбции.

Рис.2.5. Кривые равновесия при изотермической (OAD) и неизотермической абсорбции (ОАС).
При изотермической абсорбции линия равновесия характеризуется кривой OАD (рис.2.5).
В случае неизотермической абсорбции при растворении газа в жидкости температура её повышается вследствие выделения теплоты. Тогда линия равновесия характеризуется кривой ОАС.
Для технических расчётов нагреванием газа пренебрегают, считают, что вся теплота идёт на нагрев жидкости.
Если известна Т°К при данном составе, то можно найти по справочникам У* на кривой равновесия, соответствующую составу Х. Для этого нужно составить уравнение теплового баланса для части абсорбера, расположенной выше некоторого сечения с текущими концентрациями Х и У соответственно, т.е. в той части аппарата, где произошло поглощение газа:
 (2.12)
(2.12)
Здесь
 -
дифференциальная теплота растворения
газа, кДж/кмоль;
-
дифференциальная теплота растворения
газа, кДж/кмоль;
 -
расход абсорбента, моль/с; с – теплоемкость
жидкости, кДж/(кмоль·К); Т – температура
данного сечения, К;
-
расход абсорбента, моль/с; с – теплоемкость
жидкости, кДж/(кмоль·К); Т – температура
данного сечения, К;
 -
начальная температура жидкости, К.
Находим Т:
-
начальная температура жидкости, К.
Находим Т:
 (2.13)
(2.13)
С
помощью (2.13), задаваясь значениями Х в
пределах
 и
и
 находим ряд Т и по справочникам далее
находим ряд
находим ряд Т и по справочникам далее
находим ряд
 и строим по точкам ОАС.
и строим по точкам ОАС.
Как видно из рис.2.5 для случая неизотермической абсорбции произошло уменьшение движущей силы процесса. Чтобы этого избежать необходимо предусмотреть отвод тепла из аппарата.
Кинетика абсорбции.
Физическая абсорбция. Применительно к абсорбции уравнение массопередачи, если движущую силу выражают в концентрациях газовой фазы, принимает вид:
 (2.14)
(2.14)
Если движущую силу выразить в концентрациях жидкой фазы, то уравнение массопередачи имеет вид:
 (2.15)
(2.15)
Коэффициенты массопередачи определяются:
 (2.16)
(2.16)
 (2.17)
(2.17)
В
хорошо растворимых газах m
незначительно, а
 велика, т.е. мало сопротивление в жидкой
фазе, тогда
велика, т.е. мало сопротивление в жидкой
фазе, тогда
 и можно принять
и можно принять
 .
Для плохо растворимых газов можно
пренебречь диффузионным сопротивлением
в газовой фазе, так как
.
Для плохо растворимых газов можно
пренебречь диффузионным сопротивлением
в газовой фазе, так как
 велики и можно принять
велики и можно принять
 .
.
Для процесса абсорбции в уравнение массопередачи (2.14) молярные концентрации газовой фазы может быть заменены парциальными давлениями газа, выраженными в долях общего давления:
 (2.18)
(2.18)
Здесь
 -
средняя движущая сила процесса, выраженная
в единицах давления;
-
средняя движущая сила процесса, выраженная
в единицах давления;
 - коэффициент массопередачи, отнесенный
к единице движущей силы, выражаемой
через парциальные давления поглощаемого
газа.
- коэффициент массопередачи, отнесенный
к единице движущей силы, выражаемой
через парциальные давления поглощаемого
газа.
Если
равновесная линия прямая, то для
 получим:
получим:
 (2.19)
(2.19)
 (2.20)
(2.20)
Здесь
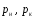 -
соответственно, парциальные давления
газа на входе в аппарат и выходе из него;
-
соответственно, парциальные давления
газа на входе в аппарат и выходе из него;
 - равновесные парциальные давления газа
на входе в аппарат и на выходе из него.
- равновесные парциальные давления газа
на входе в аппарат и на выходе из него.
Если
парциальное давление выражено в долях
общего давления Р, то коэффициенты
массопередачи
 и
и
 численно равны, если парциальные давления
выражены в единицах давления, то
численно равны, если парциальные давления
выражены в единицах давления, то
 .
.
Конструкции абсорберов.
Абсорбция протекает на поверхности раздела фаз. Поэтому абсорберы должны обеспечить развитую поверхность контакта фаз. По способу образования поверхности раздела фаз абсорберов можно разделить на 4 группы:
- плёночные
- насадочные
- тарельчатые
- распыливающие.
Плёночные абсорберы.
В данных аппаратах поверхностью контакта фаз является поверхность жидкой пленки, стекающий по вертикальной твердой стенке и контактирующей с газовым потоком. Различают следующей аппараты этого вида: трубчатые, с плоскопараллельной насадкой и с восходящим движением пленки.
Трубчатые абсорберы (рис.2.6) аналогичны на конструкции с вертикальными кожухотрубчатыми теплообменниками. Жидкий абсорбент поступает на верхнюю трубную решетку и в виде пленки стекает по внутренней поверхности труб вниз, а навстречу ему движется газовый поток по трубам со скоростью 3 – 6 м/с. Если при абсорбции выделяется тепло, то в межтрубное пространство подается охлаждающий агент.
Аппараты с плоскопараллельной насадкой (рис.2.7) представляет собой вертикальную колонну 1, внутри которой расположены вертикально и параллельно друг к другу плоские прямоугольные листы насадки 2, изготовленные из металла, пластмасс и т.д. Жидкий абсорбент течет сверху вниз, а газ снизу вверх.
Аппараты с восходящим движением пленки жидкости (рис.2.8) схожи с трубчатыми абсорберами, однако работают в режиме восходящего прямотока, Газ двигаясь большой скоростью (более 10 м/с) увлекает жидки абсорбент по трубам в виде пленки. Преимущества этих аппаратов по сравнению с противоточными трубчатыми являются большие производительности и коэффициенты массопередачи, а недостатками – большие гидравлические сопротивления, сложность конструкции, меньшие коэффициенты извлечения.
Насадочные абсорберы.
Данные аппараты представляют собой вертикальные цилиндрические колонны, заполненные твердой насадкой, предназначенной для увеличения поверхности контакта фаз. Отдельными элементами насадки могут служить тела довольной сложной формы. Разработано множество вариантов их конструкций (рис.2.9)
Как правило, насадочные аппараты работают при противоточным движении фаз: жидкая фаза подается сверху, а газовая – снизу. По мере стекания жидкости по колонне нарушается равномерность ее распределения, возникает пристеночный эффект - около стенки расхода жидкости больше, чем в центральной части живого сечения аппарата.
Для
предотвращения этого явления насадку
укладывают секциями
 (Н – высота секции, D
– диаметр колонны)
(Н – высота секции, D
– диаметр колонны)
В зависимости от относительной скорости движения газовой и жидкой фаз в насадочном аппарате можно выделить различные режимы его работы.
Пленочный режим реализуется при малых скоростях газа, что позволяет не учитывать его влияние на пленочное гравитационное течение жидкости.
Режим подвисания наблюдается при увеличении скорости газа, приводящей к торможению внешних слоев жидкой пленки, увеличению ее толщины и количеству удерживаемой жидкости.
Режим захлебывания (эмульгирования) достигается дальнейшим увеличением скорости газа. Наступает инверсия фаз - жидкость заполняет весь свободный объем насадки и становится сплошной фазой, а газ пробулькивает сквозь нее в виде отдельных пузырьков.
Режим уноса наблюдается при еще больших скоростях газа, когда жидкость выносится из аппарата.
При
различных плотностях орошения будут
аналогичные данные, но смещенные по
координате
 .
.

В справочной литературе имеются соотношения, позволяющие определить границы между режимами.
Выбор насадки.
Основные требования к насадкам:
большая
удельная поверхность
 ,
,
большая
пористость
 ,
,
высокая прочность и химическая стойкость,
низкая стоимость,
низкие гидравлические сопротивления,
хорошая смачиваемость жидкостью.
Универсальной насадки удовлетворяющей всем этим требованиям не существует.
Наиболее широкое распространение в промышленности получили кольца Рашига.
В промышленности применяются регулярные насадки и насадки навалом.
Тарельчатые абсорберы.
Тарельчатые абсорберы представляют собой, как правило, вертикальные цилиндрические колонны с горизонтальными перфорированными перегородками (тарелками), служащими для увеличения поверхности контакта фаз. Тарельчатые абсорберы обычно противоточные, жидкость подается сверху колонны, газ – снизу.
По способу перетока жидкости с верхних тарелок на нижние тарельчатые аппараты подразделяются на аппараты со сливными устройствами и без них (провальные). Наиболее распространены аппараты со сливными устройствами и перекрестным движением фаз (рис.2.12). В зависимости от фиктивной скорости движения газа можно выделить три основных режима: пузырьковый, пенный и струйный.
Ситчатые тарелки изображены на рисунках 2.12 и 2.13.Они представляют собой плиту с отверстиями 3 – 8 мм. Они просты, имеют низкие гидравлические сопротивления, высокоэффективны. Основной недостаток ситчатых тарелок – узкий диапазон устойчивой работы. Они чувствительны к загрязнениям.
Колпачковые тарелки представляют собой плиту с достаточно крупными отверстиями (более 30 мм), к которым приварены патрубки. Над каждым патрубком установлен колпачок. Колпачки имеют прорези. Газ поступает на тарелку через патрубки, а затем разбивается прорезями колпачка на множество мелких струй, проходя сквозь слой жидкости. Недостатками колпачковых тарелок – значительные гидравлическое сопротивление, металлоемкость.
Клапанные тарелки совмещают достоинства колпачковых и ситчатых тарелок. Они выполняются в виде плит с достаточно крупными отверстиями (круглые, квадратные), закрытыми сверху клапанами. В зависимости от расхода газа клапаны автоматически действием собственного веса регулируют степень открытия отверстия, приподнимаясь над ним. В случае прекращения подачи газа клапаны закрывают отверстия и жидкость через отверстия не протикает.
35. ПЕРЕГОНКА ЖИДКОСТЕЙ.
Перегонка жидкостей представляет собой процесс, в котором разделяемая жидкая смесь нагревается до кипения, а образующийся пар отбирается и конденсируется. В результате получают жидкость – конденсат, состав которого отличается от состава начальной смеси. Повторяя много раз процесс испарения конденсата и конденсации, можно практически полностью разделить исходную смесь на чистые составные части (компоненты).
Процесс перегонки основан на том, что жидкости составляющие смесь, обладают различным давлением пара при одной и той же температуре. Поэтому состав пара, следовательно, состав конденсата отличается от состава исходной смеси: легколетучего (или низкокипящего - НК) в нем больше, чем в исходной смеси. Очевидно, что в неиспарившейся жидкости концентрация труднолетучего (или высококипящего - ВК) компонента будет больше, чем в исходной смеси.
Если исходная смесь состоит из летучего и нелетучего компонента, то их разделяют выпариванием. Посредством же перегонки разделяют смеси, все компоненты которого летучи. Компоненты смеси обладают различной летучестью при одной и той же температуре.
Жидкость, полученная в результате конденсации паров называется дистиллятом (ректификатом), оставшаяся часть – кубовым остатком.
Простая перегонка – процесс однократного частичного испарения смеси и конденсации образовавшихся паров. Простую перегонку применяют для разделения смесей, летучести компонентов которой существенно различны. Обычно простую перегонку используют для предварительного грубого разделения жидких смесей.
Ректификация - наиболее полное разделение смесей жидкостей, целиком или частично растворимых друг в друге. Процесс заключается в многократном взаимодействии паров с жидкостью – флегмой, полученной при частичной конденсации паров.
При взаимодействии поднимающихся паров со стекающей жидкостью происходит частичная конденсация пара и частичное испарение жидкости (флегмы) за счет теплоты конденсации. При этом из пара конденсируется в основном ВК, а из флегмы, в основном, НК. Таким образом, стекающая флегма непрерывно обогащается ВК, а поднимающиеся пары – НК.
В результате выходящий из колонны пар состоит почти целиком из НК. Если же в дефлегматоре происходит лишь частичная конденсация паров и в качестве флегмы от водится конденсат, а оставшиеся пары конденсируются и охлаждаются в конденсаторе-холодильнике 3 с образованием дистиллята, то xФ<yD<xD.
Равновесие в системах жидкость – пар.
В общем случае жидкая смесь может состоять из нескольких компонентов. В простейшем случае из двух, например, из компонентов A и B.
Согласно
правилу фаз Гиббса, число степеней
свободы такой системы = 2 (два компонента
и две фазы):
 следовательно, из трех независимых
параметров, полностью определяющих
состояние системы – T°C,
Р и концентрации одной из фаз – можно
произвольно выбрать любые два: при этом
определяется значение третьего параметра,
которое не может быть произвольным.
следовательно, из трех независимых
параметров, полностью определяющих
состояние системы – T°C,
Р и концентрации одной из фаз – можно
произвольно выбрать любые два: при этом
определяется значение третьего параметра,
которое не может быть произвольным.
Обозначим состав жидкой фазы через x, паровой фазы – y. Тогда возможны следующие варианты фазовых диаграмм:
Р – T (x= const),
Р – x (T= const),
T – x,у (Р= const).
Для технических расчетов наиболее важна диаграмма T – x,y, т.к. обычно процесс перегонки в промышленных аппаратах происходит при P= const, т.е. в изобарных условиях.
По степени растворимости жидкости делятся:
взаиморастворимые в любых соотношениях,
идеальные растворы – подчиняются закону Рауля,
нормальные растворы – частично подчиняются закону Рауля,
неидеальные растворы – значительно отклоняются от закона Рауля,
частично взаиморастворимые,
практически взаимонерастворимые.
Взаиморастворимые жидкости в любых соотношениях.
Для идеальных растворов справедлив закон Рауля:
Парциальное
давление каждого компонента, например,
низкокипящего компонента А в паре ,
пропорционально мольной доле
,
пропорционально мольной доле
 этого компонента в жидкости. При этом
коэффициент пропорциональности равен
давлению насыщенного пара
этого компонента в жидкости. При этом
коэффициент пропорциональности равен
давлению насыщенного пара
 над жидкостью чистого компонента А при
данной T°C.
над жидкостью чистого компонента А при
данной T°C.
 (3.1)
(3.1)
 (3.2)
(3.2)
 - давления насыщенных
паров над чистыми жидкостями А и В.
- давления насыщенных
паров над чистыми жидкостями А и В.
По первому закону Дальтона, общее давление пара над раствором P равно сумме парциальных давлений его компонентов:
 (3.3)
(3.3)
Тогда
 (3.4)
(3.4)
По
второму закону Дальтона
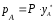 и тогда с учетом (3.1) получим:
и тогда с учетом (3.1) получим:
 (3.5)
(3.5)
По
уравнению (3.4) по известным
 и
и
 при заданной температуре кипения
при заданной температуре кипения
 и т.д. находим
и т.д. находим
 и т.д. Затем по уравнению (3.5) находим
и т.д. Затем по уравнению (3.5) находим
 и т.д. По найденным точкам строим линию
кипения жидкости и конденсации паров
(рис 3.1).
и т.д. По найденным точкам строим линию
кипения жидкости и конденсации паров
(рис 3.1).

Рис.3.1 Фазовая диаграмма T – x, y.
Здесь
линия
 - отвечает фазе, находящейся при
температуре кипения, а линия
- отвечает фазе, находящейся при
температуре кипения, а линия
 - конденсации.
- конденсации.
Любая
точка лежащая выше этой линии конденсации,
соответствует паровой фазе, пары являются
перегретыми. Точка C
характеризует систему, температура
которой выше температуры кипения и ниже
температуры конденсации паров этого
же состава. Область между линиями
 и
и
 соответствует равновесным парожидкостным
системам.
соответствует равновесным парожидкостным
системам.
По уравнениям (3.3 - 3.5) можно получить уравнение линии равновесия:
 (3.6)
(3.6)
Уравнение
получено для идеальных бинарных систем.
Обозначим
 =α
– относительная летучесть. Поскольку
давления насыщенных паров
=α
– относительная летучесть. Поскольку
давления насыщенных паров
 и
и
 чистых
компонентов А и В меняются в интервале
температур
чистых
компонентов А и В меняются в интервале
температур
 и
и
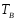 ,
то для расчета по (3.6) берут среднее α.
,
то для расчета по (3.6) берут среднее α.

 - соответствует
ТА,
- соответствует
ТА, - ТВ .
- ТВ .
Окончательно уравнение линии равновесия получим в виде:
 (3.7)
(3.7)
Таким образом, зная α, т.е. давление насыщенных паров чистых компонентов А и В, можно рассчитать и построить линию равновесия идеальных смесей. Это уравнение можно использовать и для нормальных растворов.
Поскольку
 с понижением давления снижается, то α
увеличивается. Относительная летучесть
α при понижении температуры растет
(рис.3.2).Следует отметить, что кривая
равновесия и диагональ на рис. 3.2
ограничивают область существования
двух фаз – пара и жидкости. Для диагонали
α=1.
с понижением давления снижается, то α
увеличивается. Относительная летучесть
α при понижении температуры растет
(рис.3.2).Следует отметить, что кривая
равновесия и диагональ на рис. 3.2
ограничивают область существования
двух фаз – пара и жидкости. Для диагонали
α=1.
Взаимное расположение кривых на фазовых диаграммах T – x,y и y – x как для идеальных, так и для реальных систем определяются с помощью законов Коновалова. Законы Коновалова устанавливают связь между изменением состава, давления или T в 2-х фазных системах, они лежат в основе теории перегонки и ректификации бинарных смесей.
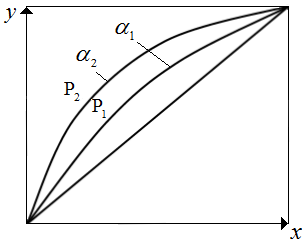
Рис.3.2
Диаграмма равновесия для бинарных
смесей:
 .
.
Первый закон Коновалова: пар обогащается тем компонентом, при добавлении которого к жидкости повышается давление пара над ней или снижается ее температура кипения, или пар всегда более обогащен НК, чем соответствующая ему жидкая равновесная фаза.
Этот
закон дополняется первым законом
Вревского, отражающим влияние T
на равновесные составы фаз: при повышении
T
бинарной смеси в парах возрастает
относительное содержание того компонента,
парциальная молярная теплота испарения
которого больше. Это можно проиллюстрировать
по рис. 3.1: при
 =
const
содержание НК в парах
=
const
содержание НК в парах
 (точка
(точка
 )
,больше его содержания
)
,больше его содержания
 в равновесной с парами жидкости (точка
в равновесной с парами жидкости (точка
 ).
При добавлении к смеси НК ее температура
кипения снижается, но содержание НК в
паре остается выше, чем в жидкости.
).
При добавлении к смеси НК ее температура
кипения снижается, но содержание НК в
паре остается выше, чем в жидкости.
Неидеальные растворы (реальные смеси) с полностью взаимной растворимостью компонентов не следует закону Рауля:
 и
и
 (3.8)
(3.8)
Здесь γ – коэффициент активности. Если γ>1 – положительное отклонение, если γ<1 – отрицательное. Определение γ часто затруднено, поэтому диаграмму y – x обычно строят по экспериментальным данным.
Для многих реальных смесей отклонение от закона Рауля настолько существенно, что приводит к качественно новому состоянию системы (рис.3.3).

Рис.3.3 Фазовые диаграммы равновесия жидкость - пар.
В реальных системах на фазовых диаграммах P – x(y) и T – x(y) возникают относительные максимумы или минимумы. При этом кривые жидкости и пара соприкасаются друг с другом в экстремальных точках. В этих точках составы равновесных фаз одинаковы. Такие смеси называют азеотропными, или азеотропами. Такая смесь при испарении не изменяет своего состава. Поэтому для их разделения применяются специальные методы.
