
- •Теоретические основы 4
- •Факторы, влияющие на состояние равновесия
- •Принцип Ле-Шателье
- •Влияние температуры. Уравнение Вант-Гоффа
- •Влияние давления на равновесие химической реакции
- •Влияние концентрации на равновесное давление химической реакции
- •Расчет равновесной степени превращения.
- •Расчет стандартной константы равновесия
- •Используя энергию Гиббса химической реакции.
- •Используя значения стандартных энергий Гиббса образования соединений или логарифмы констант равновесия.
- •Расчет коэффициентов летучести (фугитивности)
- •Определение равновесной степени превращения и равновесного состава
- •Порядок выполнения работы.
- •Вопросы к коллоквиуму
- •Литература
Влияние концентрации на равновесное давление химической реакции
Концентрация влияет в соответствии с законом действующих масс. Так, для реакции (1):
 (8)
(8)
Поскольку Kc не зависит от концентрации, то введение в равновесную систему дополнительного количества какого-либо компонента сдвигает равновесие в направлении уменьшения его концентрации. Поэтому избыток одного или нескольких исходных веществ способствует увеличению степени превращения других веществ, смещая равновесие вправо. Дополнительное введение продуктов реакции вызывает смещение равновесия влево. Удаление продуктов реакции из смеси позволяет более глубоко проводить химическое превращение. Это обстоятельство широко используют в промышленности. Так, при окислении диоксида серы в производстве серной кислоты:
2SO2+ O2<==> 2SO3
Реакцию проводят с избытком кислорода, добиваясь более полного окисления SO2, а между двумя последовательными стадиями окисления выводят из реакционной смеси SO3путем абсорбции, что позволяет еще более повысить степень окисления SO2.
Таким образом, для смещения равновесия в сторону образования целевых продуктов необходимо увеличивать концентрацию одного из исходных компонентов или снижать концентрацию продуктов реакции.
Расчет равновесной степени превращения.
Расчет равновесной степени превращения х* на основе термодинамических данных включает следующие этапы:
а) расчет
![]() по данным стандартных термодинамических
величин;
по данным стандартных термодинамических
величин;
б) расчет коэффициентов летучести (i)для каждого компонента реакционной смеси при условии, что он находится при давлении и температуре реагирующей систем, расчет величины . Так, для реакции (1)
 (9)
(9)
в) расчет константы равновесия КN:
 (10)
(10)
г) установление функциональной зависимости между КN и равновесной степенью превращенияКN = f(х*).
д) определение х* и равновесного состав продуктов.
Расчет стандартной константы равновесия
Существует несколько
методов расчета стандартной константы
равновесия
![]() .
.
Используя энергию Гиббса химической реакции.
По приводимым в
термодинамических таблицах данных
можно рассчитать стандартную энтальпию
![]() и стандартную энтропию
и стандартную энтропию![]() ,
а используя зависимостьСр
= f(T), определить
,
а используя зависимостьСр
= f(T), определить![]() и
и![]() .
.
![]()

Определение изменения энергии Гиббса реакции при данной температуре:
rG(Т) = rH(Т) – T rS(Т)
Учитывая, что rG(Т)
= – RTlnКр0, определяют
![]() .
.
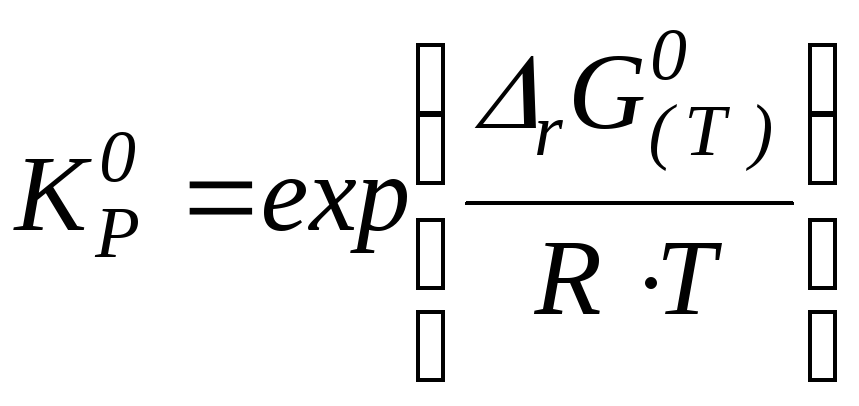
Используя значения стандартных энергий Гиббса образования соединений или логарифмы констант равновесия.
Для упрощения расчетов во многих таблицах приводят величины стандартных энергий Гиббса образования соединений при различных температурах lgKpfi.
По величинам fG(T)илиlg![]() fi
компонентов реагирующей смеси легко
можно найтиrG(Т)или
fi
компонентов реагирующей смеси легко
можно найтиrG(Т)или
![]() для реакции.
для реакции.
![]()
![]()
Используя уравнение Kp0 = f(T)
Для вычисления
![]() в широком интервале температур используют
уравнения вида:
в широком интервале температур используют
уравнения вида:
![]() ,
,
где а, в, с- коэффициенты, приведенные в справочной литературе для различных реакций.
Примеры таких уравнений приведены в табл. (Приложение 1).
Расчет коэффициентов летучести (фугитивности)
Летучесть или фугитивность - расчетная величина, которая используется в уравнении химического потенциала вместо давления.
Отношение фугитивности к давлению реального газа называется коэффициентом фугитивности .
![]() ;f =
p
;f =
p
Для идеальных газов = 1.
Для расчета фугитивности применяют различные методы. Наиболее разработанным методом расчета является метод Ньютона-Доджа. В этом методе учитывается, что если у реальных газов совпадают соответственные состояния (т.е. если = Т/Тк и = Р/Рк ), то и фугитивности их совпадают. Поэтому, рассчитав для “представительного” газапо уравнению состояния для различных состояний (Т, Р) и представив зависимость = (,)в виде таблиц или графиков, можно применять их для любых других газов. С развитием вычислительной техники более широко используется непосредственный расчетпо уравнению состояния.
График зависимости = (,)приведен в приложении 1.
Установление функциональной зависимости KN = f(х*)
Рассмотрим реакцию:
![]()
Для установления функциональной зависимости KN = f(х*)составим мольный материальный баланс процесса. Пусть:
ni0- число молей компонента в исходной смеси;
ni - число молей i-го компонента в равновесной смеси;
х*- степень превращения компонента А до установления равновесия.
Тогда количество превращенного вещества А будет равно na0·х*,количество равновесной смеси будет равноna0 - na0··х* .
Количество молей вещества Е, вступившего в реакцию, можно определить из пропорции:
A ––– E
na0·х* ––– ?
Число молей Е, вступившее в реакцию, равно na0·E/A , а в равновесной смеси содержится
![]() .
.
Аналогично определяем содержание других компонентов (см. табл.1).
Таблица 1. Расчет равновесного состава.
|
|
Содержание компонентов, моль | |||
|
А |
Е |
В |
D | |
|
Начальное содержание Компонентов, nio |
nAo |
nEo |
nBo |
nDo |
|
Превратилось (образовалось) |
- nAo·х* |
- nAo·х*· |
+ nAo·х*· |
+ na0·х*· |
|
Содержится в равновесной смеси, ni |
nAo- nAo·х* |
nEo-
nAo·х*· |
nBo
+
nAo·х*· |
nDo
+
nAo·х*· |
|
Мольная доля компонентов в авновесной смеси, Ni |
|
|
|
|
Общее число молей в равновесной смеси:
Sn = ni
= nAo
– nAo·х*
+ nEo–
nAo·х*·![]() + nBo
+ nAo·х*
·
+ nBo
+ nAo·х*
·![]() +
nDo
+nAo·х*·
+
nDo
+nAo·х*·![]()
Sn = Sno
+ nAo·х*· = Sno
+ nAo·х*·
= Sno
+ nAo·х*·![]()
Общее число молей в исходной смеси:
Sno = ni = nAo + nEo + nBo + nDo
Выразим константу равновесия КN :

 (11)
(11)
Если в исходной смеси есть инертный компонент i, то его содержаниеNi0 необходимо учитывать при подсчете общего числа молей в исходной и равновесной смеси.
