
Fizika_Ekzamen_vip
.pdf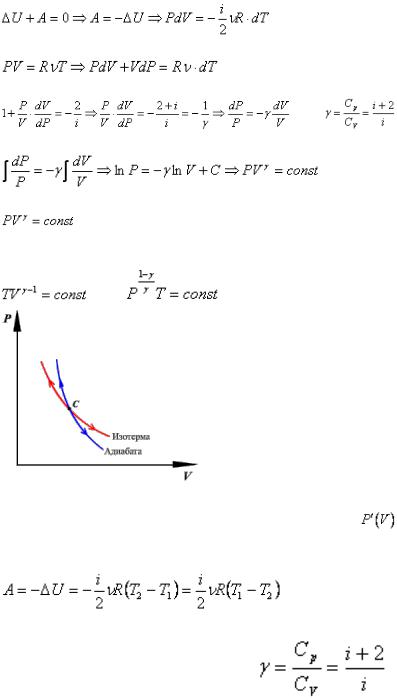
38)Адиабатический процесс. Показатель адиабаты.
Адиабатный процесс - процесс сжатия или расширения газа, происходящий без теплообмена с окружающей средой.
Из первого начала термодинамики следует, что работа газа при адиабатном процессе совершается за счет его внутренней энергии:
A |
(1). |
С другой стороны, из уравнения Клапейрона-Менделеева следует:
A |
(2). |
|
Разделим уравнение (2) на уравнение (1): |
|
|
A |
, гдеA |
. |
Проинтегрируем полученное уравнение: |
|
|
A |
. |
|
Таким образом, при адиабатном процессе |
|
|
A — уравнение Пуассона.
С учетом уравнения Клапейрона-Менделеева уравнение Пуассона может быть представлено в виде:
A |
или A |
. |
A
График адиабатного процесса — более крутая кривая, чем гипербола при изотермическом
процессе. Это следует из выражения производной A |
, полученной из уравнения |
|
Пуассона. |
|
|
Работа газа при адиабатном процессе равна убыли внутренней энергии: |
||
A |
. |
|
где γ — показатель адиабаты (коэффициент Пуассона).(из 36 билета)
39)Тепловые машины. КПД тепловой машины. Цикл Карно.
Тепловая машина
Тепловой машиной называется устройство, которое преобразует теплоту в работу или обратно и действует строго периодически, т. е. после завершения цикла возвращается в исходное состояние.
КПД тепловой машины
КПД тепловой машины называется отношение работы, произведенной этой машиной за один цикл, к теплоте, поглощенной в ходе рассматриваемого цикла.
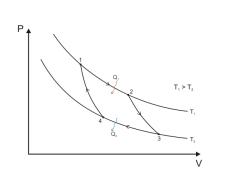
Цикл Карно́— идеальный термодинамический цикл. Тепловая машина Карно, работающая по этому циклу, обладает максимальным КПД из всех машин, у которых максимальная и минимальная температуры осуществляемого цикла совпадают соответственно с максимальной и минимальной температурами цикла Карно. Состоит из 2 адиабатических и 2 изотермических процессов.
Кпд Карно равен - 
Пусть тепловая машина состоит из нагревателя с температурой , холодильника с температурой и рабочего тела.
Цикл Карно состоит из четырёх стадий:
1)Изотермическое расширение (на рисунке — процесс 1→2). В начале процесса рабочее тело имеет температуру Тн, то есть температуру нагревателя. Затем тело приводится в контакт с нагревателем, который изотермически (при постоянной температуре) передаёт ему количество теплоты Qн. При этом объём рабочего тела увеличивается.
2)Адиабатическое расширение (на рисунке — процесс 2→3). Рабочее тело отсоединяется от нагревателя и продолжает расширяться без теплообмена с окружающей средой. При этом его температура уменьшается до температуры холодильника.
3)Изотермическое сжатие (на рисунке — процесс 3→4). Рабочее тело, имеющее к тому времени температуру Tх, приводится в контакт с холодильником и начинает изотермически сжиматься, отдавая холодильнику количество теплоты Qх.
4)Адиабатическое сжатие (на рисунке — процесс 4→1). Рабочее тело отсоединяется от холодильника и сжимается без теплообмена с окружающей средой. При этом его температура увеличивается до температуры нагревателя.
40)Барометрическая формула. Распределение Больцмана.
При изменении положения относительно оси Z в атмосфере меняется величина давления. Возьмем мысленное увеличение по оси Z, тогда давление уменьшится и:
−dp = ρgdh |
PV = m RT |
|
|
|
M |
|
m |
= mRT |
|
ρ |
MP |
dp = − MPg dh |
ρ = mPM = PM |
|
|
mRT RT |
|
RT |
|
|
dp = − Mg dh |
||
P |
RT |
|
Интегрируем(Температура не меняется)
ln p = − Mgh + ln C RT
Проецируем
p = C exp(− Mgh)
RT
При h = 0 →C = p0
p = p0 exp(− Mgh)
RT
Это и есть барометрическая формула.
Распределение Больцмана.
Распределение Больцмана получается из барометрическй формулы путем преобразований.
p = p0 exp(− Mgh)
RT
Т.к. AM = m , где m - масса молекулы, k - постоянная Больцмана и Ap = nkT ,Ap0 = n0 kT , то
R k
получим:
n = n0 exp(− mgh) kT
Здесь n - концентрация молекул на высоте h, An0 - концентрация молекул на высоте Ah0 =0.
εn = mgh
n = n0 exp(− εn ) kT
где A — потенциальная энергия молекулы. В однородном поле силы тяжести A |
. |
41)Распределение Максвелла молекул по скоростям.
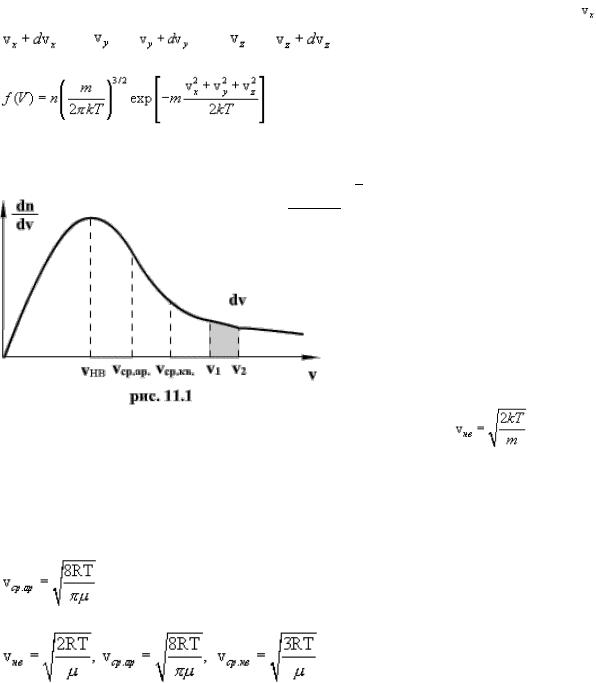
Скорости молекул газа имеют различные значения и направления, причем из-за огромного числа соударений, которые ежесекундно испытывает молекула, скорость ее постоянно изменяеться. Поэтому нельзя определить число молекул, которые обладают точно заданной скоростью v в данный момент времени, но можно подсчитать число молекул, скорости которых имеют значение, лежащие между некоторыми скоростями v1 и v2 . На основании теории вероятности Максвелл установил закономерность, по которой можно определить число молекул газа, скорости которых при данной температуре заключены в некотором интервале скоростей. Согласно распределению Максвелла, вероятное число
молекул в единице объема; компоненты скоростей которых лежат в интервале от A до
A |
, от A до A |
и от A до A |
, определяются функцией распределения |
Максвелла |
|
|
|
A
где m - масса молекулы, n - число молекул в единице объема. Отсюда следует, что число молекул, абсолютные значения скоростей которых лежат в интервале от v до v + dv, имеет
вид |
3 |
|
mv2 |
|
|
|
|
m 2 |
− |
2 |
dv |
||
2 kT |
||||||
dn = 4πn |
|
e |
|
v |
||
|
2πkT |
|
|
|
|
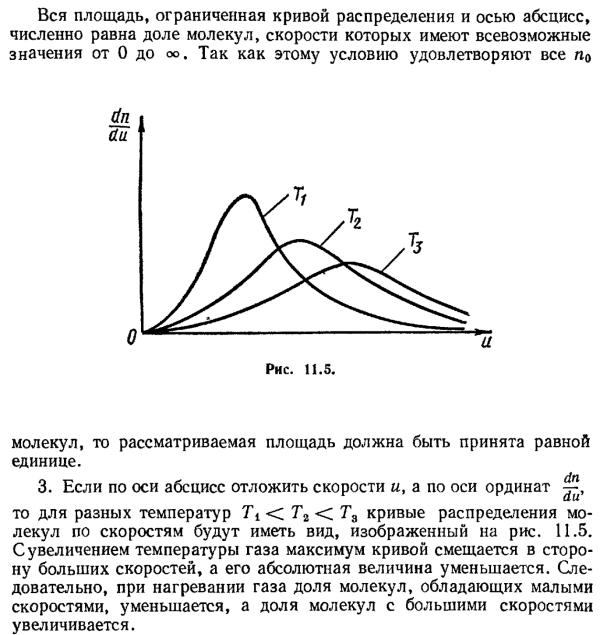
Распределение Максвелла достигает максимума при скорости A , т.е. такой скорсти, к которой близки скорости большинства молекул. Площадь заштрихованной полоски с основанием dV покажет, какая часть от общего числа молекул имеет скорости, лежащие в данном интервале. Конкретный вид функции распределения Максвелла зависит от рода газа (массы молекулы) и температуры. Давление и объем газа на распределение молекул по скоростям не влияет.
Кривая распределения Максвелла позволит найти среднюю арифметическую скорость
A . Таким образом,
A
С повышением температуры наиболее вероятная скорость возрастает, поэтому максимум распределения молекул по скоростям сдвигается в сторону больших скоростей, а его абсолютная величина уменьшается. Следовательно, при нагревании газа доля молекул, обладающих малыми скоростями уменьшается, а доля молекул с большими скоростями увеличивается.
A
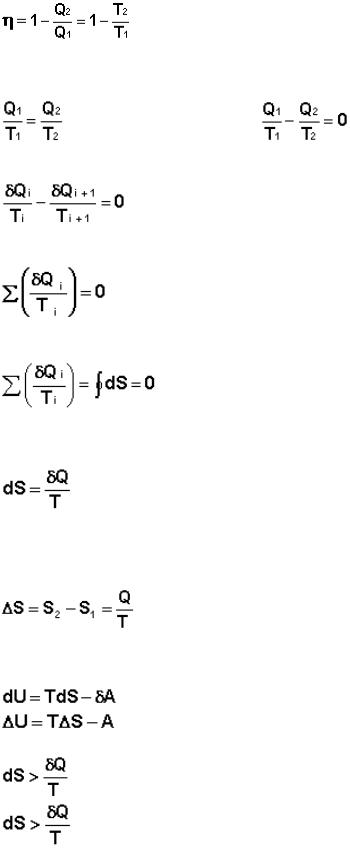
42)Энтропия и её свойства. Изопроцессы и цикл Карно в переменных T и S.
Мерой связанной энергии является новая термодинамическая функция состояния, называемая энтропией.
Введем определение энтропии, основываясь на цикле Карно. Преобразуем выражение (I.41) к следующему виду:
A |
(I.45) |
Отсюда получаем, что для обратимого цикла Карно отношение количества теплоты к температуре, при которой теплота передана системе (т.н. приведенная теплота) есть величина постоянная:
A (I.46) A (I.47)
Это верно для любого обратимого циклического процесса, т.к. его можно представить в виде суммы элементарных циклов Карно, для каждого из которых
A |
(I.48) |
Т.о., алгебраическая сумма приведённых теплот для произвольного обратимого цикла равна нулю:
A |
(I.49) |
Выражение (I.49) для любого цикла может быть заменено интегралом по замкнутому контуру:
A |
(I.50) |
Если интеграл по замкнутому контуру равен нулю, то подынтегральное выражение есть полный дифференциал некоторой функции состояния; эта функция состояния есть
энтропия S:
A |
(I.51) |
Выражение (I.51) является определением новой функции состояния – энтропии и математической записью второго начала термодинамики для обратимых процессов. Если система обратимо переходит из состояния 1 в состояние 2, изменение энтропии будет равно:
A |
(I.52) |
Подставляя (I.51, I.52) в выражения для первого начала термодинамики (I.1, I.2) получим |
|
совместное аналитическое выражение двух начал термодинамики для обратимых |
|
процессов: |
|
A |
(I.53) |
A |
(I.54) |
Для необратимых процессов можно записать неравенства: |
|
A |
(I.55) |
A |
(I.56) |
A |
(I.57) |
Т.о., как следует из (I.57), работа обратимого процесса всегда больше, чем того же процесса, проводимого необратимо. Если рассматривать изолированную систему (δQ = 0), то легко показать, что для обратимого процесса dS = 0, а для самопроизвольного необратимого процесса dS > 0.
Свойства энтропии:
В изолированных системах самопроизвольно могут протекать только процессы, сопровождающиеся увеличением энтропии.
Энтропия изолированной системы не может самопроизвольно убывать.
Энтропия изолированной системы, находящейся в равновестном состоянии, максимальна. Оба этих вывода также являются формулировками второго начала термодинамики.
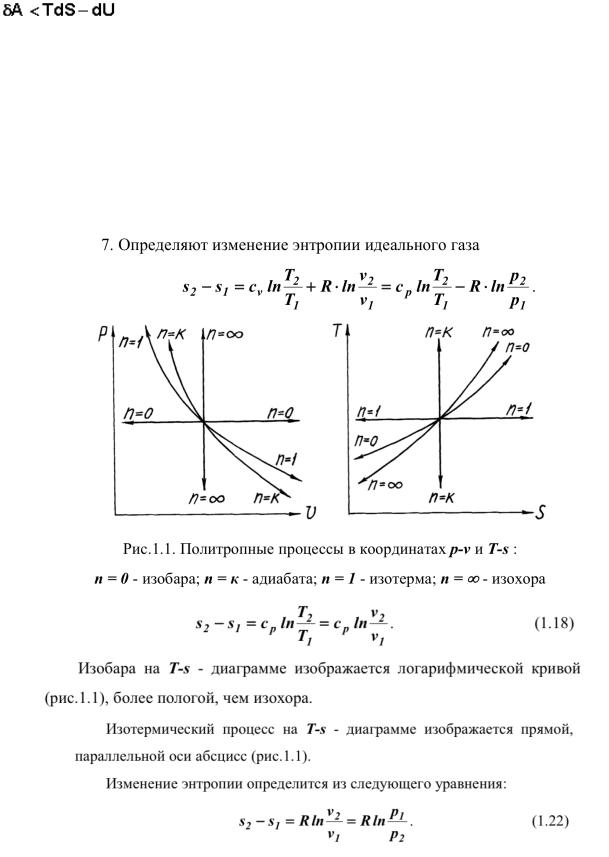
Энтропия в изопроцессах.

