
- •Транскрипция
- •Центральная догма генетики.
- •Транскрипция ДНК → РНК
- •Синтез РНК на ДНК-матрице – последовательность синтезированной мРНК комплементарна последовательности одной из цепей
- •Подтверждение роли РНК как посредника между ДНК и белком:
- •Все это говорит о том, что генетическая информация, записанная в ДНК, передается на
- •Гены – транскрибируемые участки ДНК
- •Знаки начала и окончания матричных синтезов
- •Принципы транскрипции
- •Асимметричность
- •Общие параметры транскрипции
- •Транскрипция генов в хромосоме
- •РНК-полимераза
- •Промоторы, связывание с ДНК-матрицей и -субъединица
- •У прокариот, подобных E. coli, σ (sigma) субъединица RNA polymerase связывается с районом
- •Промоторы разных генов слегка отличаются.
- •Важны два понятия 1) консенсусные последовательности ДНК – гомологичные
- •Инициация транскрипции и элонгация РНК
- •После инициации, σ (сигма) субъединица отделяется от холофермента, и продолжается удлинение цепи под
- •После прохождения всего гена фермент встречает сигнал терминации. Терминальная последовательность длиной около 40
- •Гены, кодирующие близкородственные продукты, у бактерий часто сгруппированы на хромосоме. Часто эти прилегающие
- •Транскрипция у эукариот
- •Первичный РНК-транскрипт подвергается процессингу или созреванию – обычно к 5’ концу добавляется кэп,
- •Инициация транскрипции у эукариот
- •Один из таких цис-элементов – ТАТА-бокс или блок Голдберга- Хогнесса – был обнаружен
- •Второй цис-элемент – СААТ-бокс локализован в промоторах большинства генов, примерно на 80 нуклеотидов
- •Другой класс цис-активирующих элементов – энхансеры, которые локализуются на обоих концах (3’ и
- •Эукариотическая РНК-полимераза (RNP) существует в трех уникальных формах, каждая из которых транскрибирует различные
- •Гетерогенные ядерные РНК и их процессинг – кэпы и хвосты
- •Первичная посттранскрипционная модификация эукариот
- •Затем обнаружили, что гяРНК и иРНК имеют на 3’ конце последовательность из 250
- •У эукариот, начальный транскрипт называется гетерогенной ядерной РНК (hnRNA), или пре-мРНК, содержащей некодирующие
- ••Поли-А "хвост" добавляется с разрезанному 3‘-концу.
- •Интроны и прерывистые гены
- •Большинство эукариотических генов содержат интроны. Ген овальбумина кур в основном «молчащий", содержит семь
- •Подавляющее большинство эукариотических генов содержит интроны, есть всего несколько исключений. Экзоны составляют 15%
- •Процессинг (созревание) пре-иРНК играет регуляторную роль в экспрессии генов. К примеру, некоторые интроны
- •Трансляция
- •и-РНК → БЕЛОК
- •Матричный принцип в трансляции – генетический код
- •Участники трансляции Переводчики:
- •Какие молекулы в клетке знают генетический код?
- •Адапторная гипотеза Крика
- •Транспортные РНК
- •Сколько разных т-РНК ?
- •АРСазы
- •Матричная РНК
- •Этапы трансляции
- •Инициация трансляции
- •Инициация
- •Элонгация
- •фМет
- •Терминация
- •Параметры трансляции
- •Структура рибосом
- •Рибосомы прокариот состоит из большой и малой субъединиц. Обе субъединицы состоят из одной
- •Эукариотические рибосомы структурно похожи на прокариотические, состоят из большой и малой субъединиц, каждая
- •Степеь избыточности генов, кодирующих рРНК.
- •Структура тРНК
- •1965 г. – Р. Холли расшифровал последовательность тРНК аланина. Оказалось, что ряд нуклеотидов
- •tRNA нуклеотиды могут содержать азотистые основания, модифицированные после
- •Холли предложил двумерную модель молекулы тРНК в виде клеверного листа – несколько спаренных
- •Молекула тРНК содержит много модифицированных оснований и содержит ряд стеблей и петель, сложенных
- •Анализ структуры других тРНК выявил много общего.
- •Зарядка молекул тРНК
- •«Зарядка» тРНК начинается, когда аминоацил-тРНК-синтетаза катализирует превращение аминокислоты в аминоациладениловую кислоту.
- •Инициация трансляции в E.coli затрагивает рибосомы, мРНК, энергоноситель GTP, несколько факторов инициации (IFs)
- •Инициация трансляции.
- •Элонгация трансляции: шаг 1.
- •Элонгация трансляции: шаг 2.
- •Элонгация трансляции: шаг 3.
- •Элонгация трансляции: шаг 4.
- •Элонгация трансляции: шаг 5.
- •Элонгация трансляции: шаг 6.
- •Терминация синтеза белка сигнализируется появлением стоп-кодона на A site: UAG, UAA, или UGA.
- •Полирибосомы
- •Полисома
- •Трансляция у эукариот
- •Инициация трансляции у эукариот имеет свои особенности. За счет появления на 5’ конце
- •В трансляции участвуют белки, сходные или гомологичные факторам инициации, элонгации и терминации у
Структура тРНК
Наиболее хорошо изучены небольшие стабильные тРНК. Всего 75-90 нуклеотидов, молекулярная структура у про- и эукариот почти одинакова.
4S тРНК образуется в результате процессинга из более длинных предшественников. У E coli тРНК, акцептирующая тирозин состоит из 77 нуклеотидов, ее предшественник – из 126.
1965 г. – Р. Холли расшифровал последовательность тРНК аланина. Оказалось, что ряд нуклеотидов уникален только для этой аланиновой тРНК. Одно из 4 оснований модифицировано в виде инозиновой кислоты, гипоксантина,
риботимидиновой кислоты и псевдоуридина. Эти модификации – необычные, редкие или непарные основания
появляются в ходе последующих посттранскрипционных изменений, а в процессе транскрипции в пре-тРНК встраиваются немодифицированные основания, которые изменяются под действием ферментов.

tRNA нуклеотиды могут содержать азотистые основания, модифицированные после
транскрипции.
Благодаря качанию, I (Inosine) и Im могут спариваться с U, C, или A.
Холли предложил двумерную модель молекулы тРНК в виде клеверного листа – несколько спаренных стеблей (за счет спаривания оснований) и неспаренных петель.
Поскольку GCU, GCC и GCA кодируют аланин, Холли попытался найти соответствующий антикодон в молекуле ала- тРНК и обнаружил его в виде CGI (3’-5’). Основание I (инозиновая кислота) может формировать водородные связи с U, С или А – третьими рибонуклеотидами в этих кодонах. В результате – антикодоновая петля
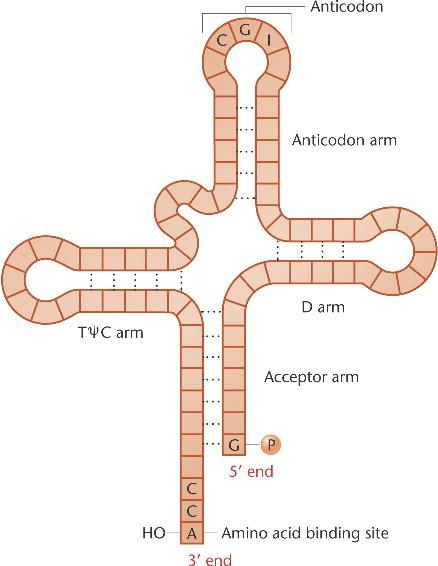
Молекула тРНК содержит много модифицированных оснований и содержит ряд стеблей и петель, сложенных в 3-мерную конфигурацию.
3‘-конец - сайт связывания аминокислоты, в то время как антикодоновая петля узнает кодон на мРНК.
Антикодон (CGI) этой молекулы tRNAala специфичен для
аминокислоты аланина, а также может ообразовывать пару с триплетами GCU, GCC, и GCA из- за качания.
Анализ структуры других тРНК выявил много общего.
На 3’ конце у всех тРНК есть последовательность ССА-3. К концевому остатку аденозина на этом конце ковалентно присоединяется аминокислота. На другом конце – 5’-G. Очень сходны размеры стеблей и петель. Каждая тРНК имеет антикодон, комплементарный соответствующему триплету, кодирующему определенную аминокислоту
Трехмерная модель тРНК – на основе кристаллографического исследования
Зарядка молекул тРНК
Для успешной трансляции молекулы тРНК должны присоединить соответствующие аминокислоты. Такая зарядка тРНК происходит с участием аминоацил-тРНК- синтетазы. Если разных аминокислот 20, то нужно не менее 20 разных тРНК и ферментов. Теоретически это число может соответствовать числу различных кодонов (61). Но качание третьего нуклеотида в кодоне снижает это количество до 32 тРНК и 20 синтетаз.
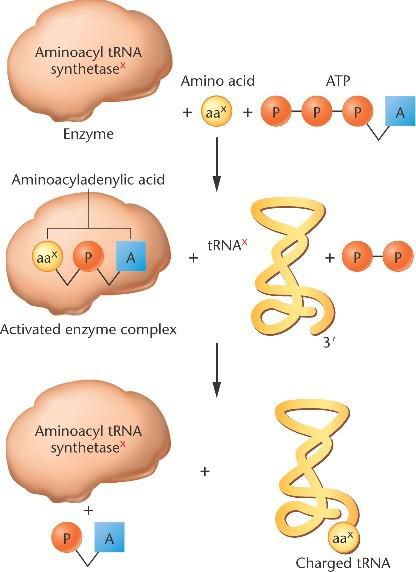
«Зарядка» тРНК начинается, когда аминоацил-тРНК-синтетаза катализирует превращение аминокислоты в аминоациладениловую кислоту.
Гидролизованная ATP отщепляет фосфат с образованием комплекса.
Аминокислота перемещается в соответствующую тРНК на 3‘-конец.
Такая заряженная молекула может участвовать в синтезе белка.
Аминоацил-тРНК-синтетазы – высокоспецифичные ферменты, узнающие только одну аминокислоту. Набор соответствующих аминокислоте тРНК называют изоакцепторными тРНК.
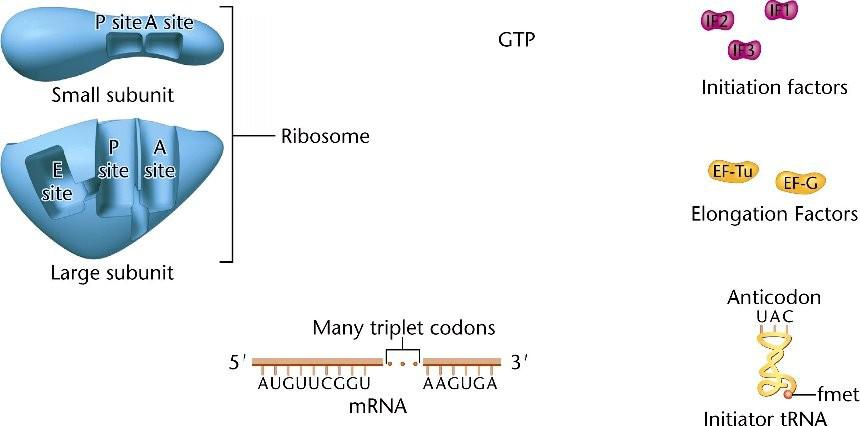
Инициация трансляции в E.coli затрагивает рибосомы, мРНК, энергоноситель GTP, несколько факторов инициации (IFs) и тРНК, которая несет антикодон UAC и заряжена модифицированной аминокислотой N-формилметионином (f-met).
E, P и А сайты на рибосоме.
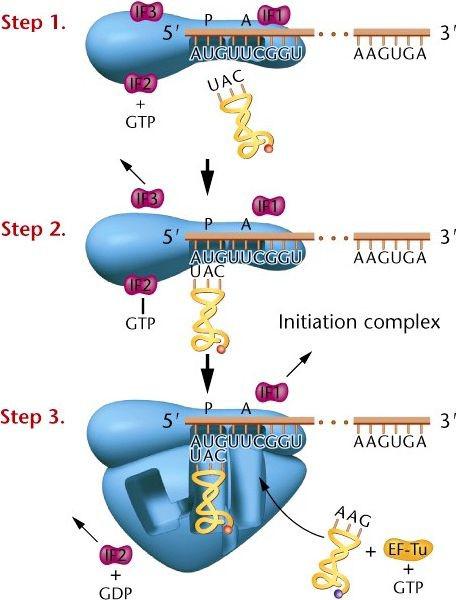
Инициация трансляции.
Малая субъединица рибосомы связывается с несколькими факторами инициации (IF1, 2, 3); Этот комплекс связывается с мРНК.
Инициирующий tRNAfmet связывается с mRNA AUG кодоном в P (пептидильном) сайте. GTP гидролизуется, обеспечивая реакцию энергией.
Большая единица связывается с комплексом. Фактор элонгации Tu
связывается со следующей tRNA, содействуя вступлению в A (аминоацильный) сайт.
