
- •Белки, наследственность и обмен веществ
- •Фенилкетонурия
- •Для метаболизма аминокислот фенилаланина и тирозина требуется несколько ферментов.
- •Гипотеза один ген – один фермент
- •Опыты Билла и Татума с мутантами нейроспоры
- •Бидл и Татум (Nobel 1958) индуцировали ауксотрофные мутации питания в Neurospora, подвергая бесполые
- •При попытке вырастить мутанты на минимальной среде с добавлением различных органических соединений, мутации
- •Бидл и Татум смогли определить, что каждая генетическая мутация связана с потерей ферментативной
- •Гены и ферменты – биохимический анализ
- •Метаболический путь для синтеза аминокислоты аргинина в Neurospora был установлен путем предоставления смеси
- •Один ген – одна полипептидная цепь
- •Серповидноклеточная анемия
- •Коллинеарность между генами и полипептидами
- •Полинг (Nobel 1954) изолировал нормальные (HbA) и серповидные (HbS) молекулы гемоглобина человека и
- •Белок расщепляется на пептидные фрагменты протеолитическими ферментами.
- •Коллинеарность в гене trpA, который кодирует A субъединицу фермента триптофан синтетазы в E.coli
- •Структура и биологическое разнообразие белков
- •Аминокислоты содержат карбоксильную группу, амино группу и R группу, связанную с центральным углеродом
- •Ковалентная пептидная связь образуется, когда аминогруппа одной аминокислоты реагирует с карбоксильной группой другой
- •Известно 4 уровня белковой структуры. Первичная
- •Водородные связи в регулярных, повторяющихся фрагментах стабилизируют секции полипептида, образуя альфа-спиральную вторичную структуру.
- •Водородная связь может также образовать бета-складчатый лист вторичной структуры в плоскости зигзага.
- •Если вторичная структура белка описывает порядок аминокислот в определенной области полипептидной цепи, то
- •Четвертичная структура характерна только для белков, состоящих из двух и более полипептидных цепей,
- •Некоторые белки, особенно ферменты, являются олигомерами: состоят из более, чем одной полипептидной цепи.
- •Посттрансляционная модификация белков
- •Функции белков
- •Белковые домены и перетасовка экзонов
- •1985 г – мембранный рецептор липопротеинов низкой плотности LDL (в транспорте холестерола) –
- •Ген человеческого рецептора холестерина содержит 18 экзонов, кодирующих 5 доменов в белке.
- •Различные молекулы гемоглобина производится в
- •Генные мутации
- •Классификация мутаций
- •Спонтанные и индуцированные мутации
- •Спонтанные мутации происходят естественно и случайно и, как правило, связаны с нормальными биологическими
- •Герминальные и соматические мутации
- •Другие виды мутаций
- •Следующий тип мутаций касается регуляции работы генов.
- •Уровень спонтанных мутаций
- •Молекулярная основа мутаций
- •Точечные мутации являются заменами оснований, в которых одна пара нуклеотидов изменяется.
- •Таутомерные сдвиги
- •Нуклеотиды могут существовать в таутомерных формах (структурных изомеров) из-за изменения положения протона (таутомерного
- •Мутация транзиции.
- •В следующем раунде репликации, несоответствующие члены пар оснований разделяются; таутомер обычно смещается назад
- •Аналоги оснований
- •5-бромурацил (5-BU) - производное урацила и ведет себя как аналог тимина, который увеличивает
- •Алкилирующие соединения
- •Акридиновые красители и мутации сдвига рамки
- •Акридиновый красители, такие как профлавин и
- •Апуриновые сайты и дезаминирование
- •Причиной некоторых мутаций может стать дезаминирование, т.е. превращение аминогруппы в кето-.
- •Химические мутагены, такие как азотистая кислота (HNO2) может привести к
- •Ультрафиолет и жесткая радиация
- •Воздействие УФ-излучения может привести к созданию димеров тимина в ДНК. Димеры искажают конформацию
- •Ионизирующая радиация
- •Коротковолновая радиация, такая как Х-лучи, называется ионизирующей радиацией.
- •Определенные стадии клеточного цикла оказались более чувствительными к радиации. Рентгеновские лучи могут вызывать
- •Выявление мутагенности: тест Эймса
- •Тест Эймса подвергает ауксотрофные штаммы сальмонеллы (his–)
- •Исправление повреждений ДНК: системы репарации
- •Фотореактивная репарация у прокариот
- •Фотореактивная
- •Эксцизионная репарация у прокариот и эукариот
- •Известно два типа эксцизионной репарации – репарация оснований и репарация нуклеотидов.
- •Репарация оснований в E.coli.
- •Эксцизионная репарация нуклеотидов.
- •Репарация ошибок репликации
- •Но как система репарации должна узнать, какая цепь матричная, а какая вновь синтезированная
- •Пострепликативная репарация и система SOS-репарации
- •Пострепликационная репарация.
- •Пострепликационная репарация :
- •Пострепликационная репарация :
- •У E. coli обнаружена также система SOS-репарации, исправляющая повреждения ДНК другим способом. Если
- •Репарация разрывов двойной спирали у млекопитающих
- •Как и при пострепликативной репарации, при репарации двуцепочечных разрывов происходит гомологичная рекомбинация, поскольку
- •Мобильные генетические элементы
- •Встроенные последовательности
- •Анализ последовательностей большинства известных IS единиц обнаружил характерные для них структуры – инвертированные
- •Элементы бактериальной инсерционной последовательности (IS) содержат ген, который кодирует фермент, называемый транспозазой, что
- •Бактериальные транспозоны
- •Бактериальные транспозоны (Tn элементы) больше, чем IS элементы и содержат белок- кодирующие гены
- •IR сегменты могут гибридизованы после разделения первоначального дуплекса, образуя гетеродуплексные петли, которые можно
- •Система Ac-Ds у кукурузы
- •Позже такие элементы обнаружены и у других организмов. Оказалось, что IS элементы и
- •Транспозоны.
- •Транспозоны:
- •Транспозоны:
- •Сравнение структуры Ac и Ds элементов.
- •Copia и Р-элементы у дрозофилы
- •Каждый элемент copia (транскрибируется в "обильные" количества РНК) состоит из перевернутого концевого повтора
- •Другая группа мобильных элементов дрозофилы – семейство Р- элементов. Это семейство открыли при
- •Мобильные элементы у человека
- •Процессированные псевдогены
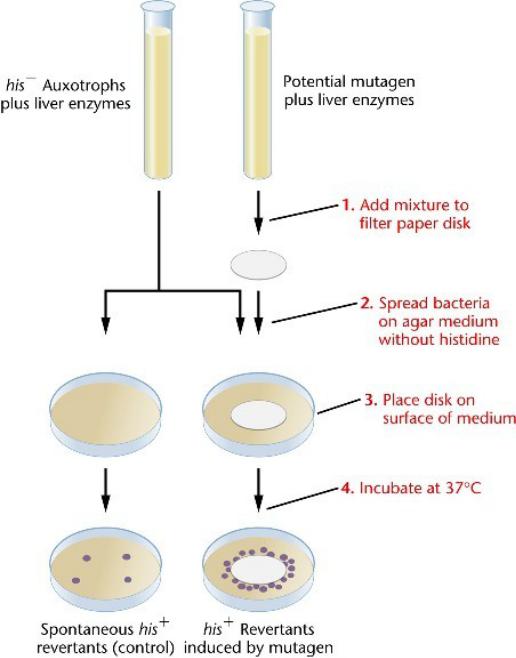
Тест Эймса подвергает ауксотрофные штаммы сальмонеллы (his–)
воздействию химических соединений, чтобы оценить их мутагенность.
Экстракт печени добавляют, так как метаболические изменения этих соединений в печени может сделать их мутагенными.
Мутагенность химических веществ находит свое отражение в частоте обратных мутаций, которые дают прототрофы дикого типа (his+).
Исправление повреждений ДНК: системы репарации
Фотореактивная репарация у прокариот
При исследовании мутагенности УФ было обнаружено множество типов репарации повреждений ДНК.
В 1949 г. А. Кельнер открыл репарацию индуцированных ультрафиолетом нуклеотидных сшивок – фотореактивацию.
Повреждения ДНК, индуцированные у E. coli УФ, можно частично восстановить, если после облучения поместить бактерии под синий свет. Фотореактивная реакция зависит от температуры, т.е. это ферментативная реакция.
Позднее показано, что репарация зависит от активности фермента –
фермента фотореактивации (PRE). Этот фермент расщепляет ковалентные связи между остатками Т в тиминовых димерах и восстанавливает структуру ДНК. Для активации молекулы фермента требуется фотон, но затем свет не нужен. Клетки E. coli могут обойтись без этого фермента, поскольку нуль-мутация в гене, кодирующем этот фермент, не летальна.
У человека и других эукариот такой системы фотореактивации нет.

Фотореактивная
репарация.
В E. coli фермент фотореактивации (PRE) может расщеплять связи между тиминовыми димерами, заряжаясь от фотона синего света.
Реакция обратна действию УФ-излучения на ДНК.
Эксцизионная репарация у прокариот и эукариот
В 60-е годы у прокариот обнаружена и другая зависимая от света
система репарации повреждений ДНК. В основе ее лежит механизм эксцизионной репарации, который у прокариот и эукариот включает
три основных этапа:
1)нуклеаза узнает и вырезает ошибочное основание или измененную структуру ДНК. Такая эксцизия затрагивает одно основание или нуклеотид или несколько нуклеотидов, смежных с ошибочным. В спирали ДНК остается брешь.
2)ДНК-полимераза I заполняет эту брешь дезоксирибонуклеотидами, комплементарными нуклеотидам в неповрежденной цепи ДНК, которые пристраиваются с 3’-ОН конца.
3)ДНК-лигаза сшивает последний разрез цепи, который остается на 3’-ОН конце последней пары оснований, и закрывает брешь.
Известно два типа эксцизионной репарации – репарация оснований и репарация нуклеотидов.
При эксцизионной репарации оснований исправляются повреждения азотистых оснований, вызванные спонтанным гидролизом или химическими агентами. Первый этап такой репарации в клетках E. coli включает узнавание химически модифицированные основания ДНК- гликозилазами, специфичными для разных повреждений ДНК. Эти ферменты расщепляют связь между основанием и сахаром, и появляется апиримидиновый сайт (АР-сайт), который узнается АР- эндонуклеазой. Эндонуклеаза разрезает цепь ДНК в АР-сайте, а разрез узнается ферментами эксцизионной репарации, исправляющим это повреждение.
С помощью эксцизионной репарации нуклеотидов исправляются блоки ошибок, изменяющие структуру двойной спирали, например пиримидиновые сшивки.
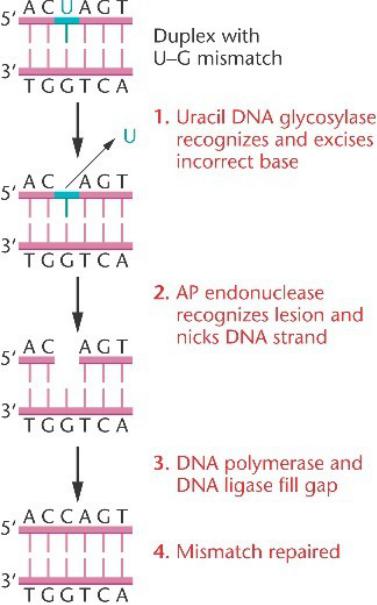
Репарация оснований в E.coli.
Несоответствие пар оснований узнается ДНК гликозилазой, которая отделяет основание от сахара, создавая апуриновый / апиримидиновый (AP) сайт.
AP эндонуклеаза делает разрез в фосфодиэфирном остове на месте AP сайта.
Этот разрыв заполняется ДНК-полимеразой I и ДНК-лигазой
Ошибка исправлена.
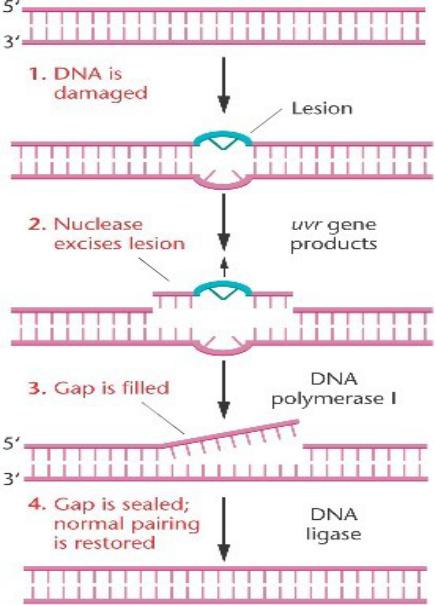
Эксцизионная репарация нуклеотидов.
Поврежденная ДНК узнается УФР (УФ репарационными) белками.
Несколько нуклеотидов вырезается вокруг всего поражения нуклеазой.
Этот разрыв заполняется ДНК- полимеразой I и ДНК-лигазой.
Ошибка исправлена.
Репарация ошибок репликации
Для исправления ошибок репликации ДНК существуют другие системы репарации. Функцию коррекции таких ошибок выполняет ДНК-полимераза III. В процессе полимеризации ДНК в молекулу могут встраиваться некомплементарные нуклеотиды, которые распознают и вырезают из цепи ДНК ферментным комплексом, а затем неправильный нуклеотид замещается комплементарным. У бактерий коррекция ошибок повышает точность синтеза ДНК на два порядка – первоначально некомплементарные нуклеотиды встречаются с частотой 10-5, после коррекции – с частотой не более 10-7.
Для исправления ошибок оставшихся после коррекции существует дополнительный механизм репарации ошибок спаривания. При повреждениях ДНК или неправильном спаривании оснований эти ошибки должны узнаваться, а неправильный нуклеотид или нуклеотиды удаляться и замещаться комплементарными.
