
- •Растворы
- •Классификация дисперсных систем
- •Дисперсные системы
- •Растворение
- •Схема гидратации растворенного вещества
- •Катион в полярном растворителе
- •Коллигативные свойства растворов
- •Давление насыщенного пара над чистым растворителем и раствором
- •Понижение давления насыщенного пара над раствором
- •Фазовая диаграмма чистого растворителя и раствора
- •Повышение температуры кипения
- •Понижение температуры замерзания
- •Осмос
- •Осмотическое давление
- •Электролиты
- •Электролитическая диссоциация
- •Слабые электролиты
- •Слабые электролиты
- •Диссоциация кислот
- •Диссоциация оснований
- •Автопротолиз воды
- •Реакция среды
- •Расчет рН кислот и оснований
- •Константы кислотности

Растворы
гомогенные системы, состоящие из двух или более компонентов, состав которых можно изменять в некоторых пределах без нарушения однородности
жидкие |
твердые |
газообразные |
Раствор = растворитель + растворенное вещество

Классификация дисперсных систем
Дисперсные |
Размеры |
Устойчивость и |
системы |
частиц |
гомогенность |
|
дисперсной |
системы |
|
системы |
|
Грубодисперсны |
10-3…10-5 см |
Неустойчивы, |
е |
(10…0,1 мкм) |
гетерогенны |
(суспензии,
взвеси)
Тонкодисперсные |
10-5…10-7 см |
Довольно |
(коллоидные |
(0,1…0,001 |
устойчивы, |
растворы) |
мкм) |
микрогетерогенн |
|
|
ы |
Молекулярно- |
~10-8 см |
Весьма |
дисперсные |
|
устойчивы, |
(истинные |
|
гомогенны |

Дисперсные системы
Дисперсионна |
Дисперсная |
Примеры |
|
|
я среда |
фаза |
|
|
|
|
газ |
газовые смеси (воздух) |
||
Газ |
жидкость |
туманы, облака |
аэрозоли |
|
|
твердое тело |
пыль, дым, порошок |
||
|
газ |
пена |
|
|
|
жидкость |
эмульсии |
(молоко, |
кремы, |
Жидкость |
|
мази, нефть), |
|
|
|
твердое тело |
суспензии, пасты, |
взвеси |
|
|
|
(глина в воде) |
|
|
|
газ |
твердые |
пены (пенопласты, |
|
Твердое тело |
|
пемза, пеностекло) |
|
|
|
жидкость |
твердые |
эмульсии |
(вода в |
|
|
парафине, |
жемчуг), |
влажные |
|
|
грунты, почвы |
|
|
|
твердое тело |
сплавы, |
минералы, бетон, |
|
|
|
композиционные материалы |
||

Растворение
сложный физико-химический процесс.
фазовый переход |
сольватация |
Нф.п. > 0, Sф.п. > 0 |
Hсольв. < 0, Sсольв. < 0 |
H = Hф.п. + Hсольв.S = Sф.п. + Sсольв.
Растворение – самопроизвольный процесс ( G < 0)
Объемные эффекты растворения:
1л С2Н5ОН + 1л Н2О = 1,93 л (25 ºС)
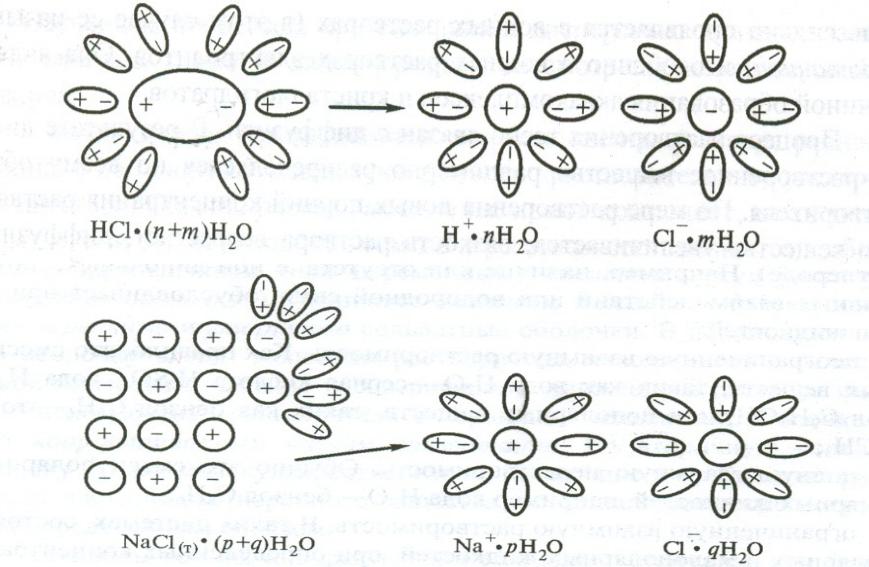
Схема гидратации растворенного вещества
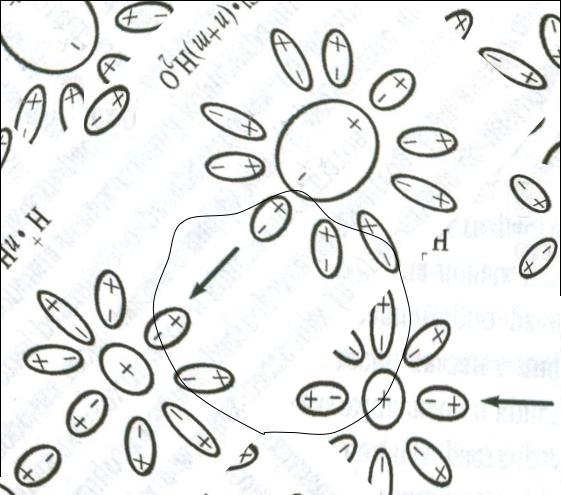
Катион в полярном растворителе
|
|
|
а – зона |
|
|
|
сольватированного |
|
|
|
иона |
|
|
в |
б – зона |
|
|
|
|
a |
б |
|
деструктурированн |
|
|
ого растворителя |
|
|
|
|
|
|
|
|
в – структура |
|
|
|
растворителя |
Коллигативные свойства растворов
– свойства, которые зависят только от концентрации растворенного вещества, от природы вещества не зависят.
Идеальные растворы – разбавленные растворы, при образовании которых тепловой и объемный эффекты равны нулю (приближение – растворы неэлектролитов)
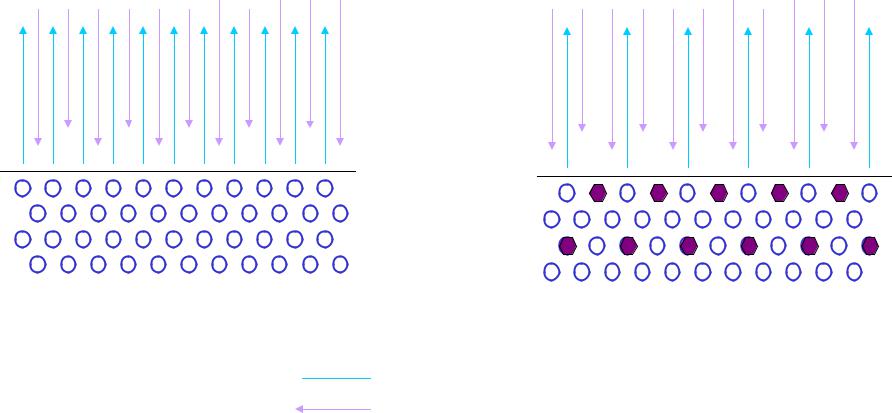
Давление насыщенного пара над чистым растворителем и раствором
чистый растворитель |
раствор нелетучего вещества |
 испарение конденсация
испарение конденсация
vиспарения= vконденсации |
vиспарения < vконденсации |
Понижение давления насыщенного пара над раствором
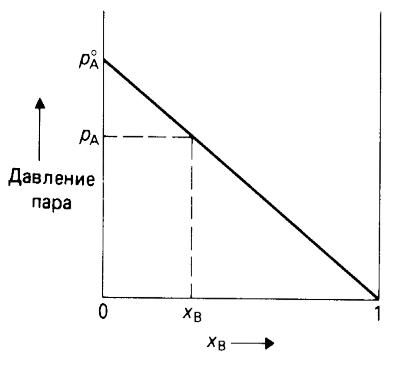
Первый закон Рауля: Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества
p |
|
|
nвещества |
|
||
p0 |
|
n |
n |
растворителя |
||
|
|
|||||
|
|
|
вещества |
|
||
Давление пара над раствором:
p p0 |
nрастворителя |
||||
|
|
|
|
||
n |
n |
растворителя |
|||
|
|||||
|
вещества |
|
|||
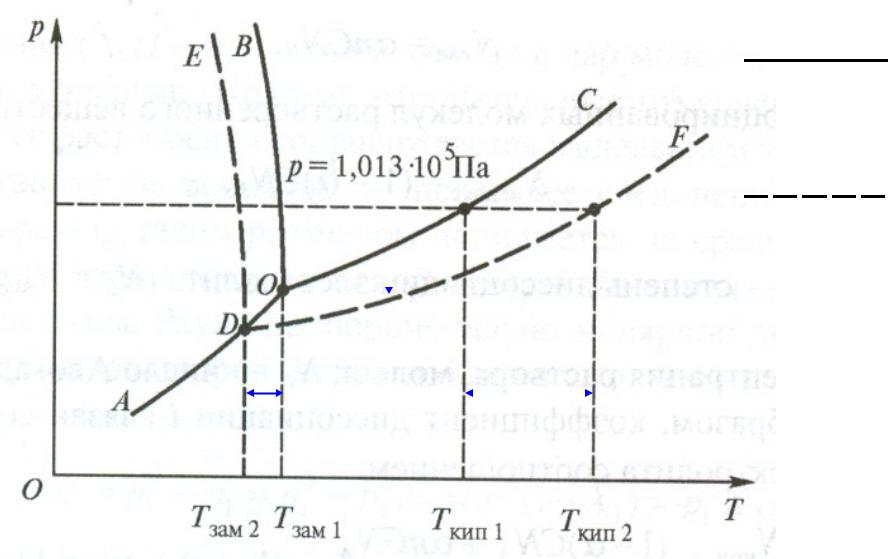
Фазовая диаграмма чистого растворителя и раствора
чистый
растворитель
раствор
 ΔР
ΔР
ΔТзам |
|
ΔТкип |
|
